Фосфати: Псевдомалахіт (Тагілі)
Діагностична карта.
Cu 5 (PO 4)2 * H 2 O
Сингонія Моноклінна
твердість 4-5
Питома вага 3,8-4,4
Спайність погана
злам раковистий
Колір зелений
Колір в порошку блакитно-зелений
блиск скляний

Зустрічається у вигляді соскоподібного мас променисто-волокнистого або концентричного полосчатим будови, малахітово-зеленого і чорно-зеленого кольору. Розчиняється в кислотах. Має зовнішню схожість з малахітом. Називається також Тагілі.
Хімічний склад - зміст (в%): CuО - 66-72; P2O5 - 20-24; H2O- 6,8 - 9,1. Призматичний вид симетрії. Розщеплення - по {010} ясна. Агрегати - Окремі кристали рідкісні. Призматичний по [001], зазвичай з нерівними гранями і малих розмірів. Кристали часто з'єднані в субпараллельно агрегати з друзовая поверхнею або в півсфери; також ниркоподібний, гроздевідное або масивний з радіально-волокнистої структурою і концентрической полосчатостью; волокна подовжені уздовж [010]; лістоватимі; мікрокристалічний або щільний; колломорфним.
Походження.
Поширений як вторинний мінерал, що утворюється в зонах окислення родовищ міді в асоціації з малахітом, хризоколлой, тенорітом, піроморфітом.
Псевдомалахіт Cu 5 (PO 4)2 * H 2 O (містить фосфор і воду, фосфат) відрізняється від малахіту - Cu 2 (CO 3) * (OH) 2 хімічною формулою (карбонат). Сам по собі малахіт не дуже твердий, крихкий, при ударі розпадається на шматки, реагує на соляну кислоту з бурхливим скипанням - вторинний мінерал, що утворюється в зоні приповерхневого окислення міднорудних родовищ. Псевдомалахіт (його називають також "Собака Баськервіллей" або "білорус") - результат активної вулканічної діяльності в зоні термальною водяній вулканічної кальдери (джерело гарячої термальної води, пар) і містить фосфор. Болота.
Місце народження.
Виявлено в Ликаси в провінції Шаба (Заїр), в Тюрінгії (Німеччина), на півострові Корнуолл (Англія), у Франції, Бельгії, штаті Пенсільванія (США) і Австралії. Псевдомалахіт - вторинний мінерал. Зустрічається разом з кварцом, халцедоном, малахітом, купріта, хризоколлой, тенорітом, лимонитом. Родовища: Німеччина (Рейнланд, гори Тюрингенский Ліс близько Хофа та ін.), Англія (Корнуолл), Португалія, а також велику кількість в Росії (Нижній Тагіл, звідки друга назва мінералу - Тагіл).


Псевдомалахіт. Меднорудянское родов, Ніж. Тагіл, Ср.Урал, РФ (СНД). Фото: © А.А. Євсєєв.

Псевдомалахіт ( "еліт") - синювато-зелений прожилок в малахіт (смугою в центрі).
Меднорудянскій р-к, Ніж. Тагіл, Ср. Урал, Росія, СНД. Фото: © А.А. Євсєєв.
Навколо блакитного псевдомалахіта - осклованих зелений малахіт типу кімберлітового
Тектіти, результат входження в літосферні шари і породи земної кори розпеченого уранового
метеоритного боліда і формування наскрізної кимберлитовой трубки в землі, пробій до магми.
Землетрус, тікають щури, ховаються домашні тварини, мор (хвороби і смерті), "Апокаліпсис"
Малахіт Cu 2 (CO 3) * (OH) 2
Псевдомалахіт Cu 5 (PO 4)2 * H 2 O
Зведемо формули по однаковій кількості атомів міді:
Малахіт 5 х (Cu 2 (CO 3) * (OH) 2
Псевдомалахіт 2 х (Cu 5 (PO 4)2 * (H 2 O)
Розберемо формули за кількістю атомів:
Малахіт Cu 10 (C 5 O 15) * O 10 H 10
Псевдомалахіт Cu 10 (P 4 O 16) * H 4 O 2
Малахіт Cu 10 C 5 O 25 * H 10
Псевдомалахіт Cu 10 P 4 O 18 * H 4 - додали фосфор P
Різниця атомів - C 5 O 7 * H 6 = 3 х (H 2 O) + 5 х C + O 4 (*)
- Вуглець (алмаз) = 3 х (H 2 O) + 2 х (CO 2) + C 3 (**)
- Вуглець (карбонадо) = 3 х (H 2 O) + 2 х (CO) + (CO 2) + C 2 (***)
- Комбінація атомів ( "СТ") = 5 х (CO) + O 2 + 3 х H 2 (****, "газ")
- Комбінація атомів ( "СТ") = 5 х (CO) + 2 х (HO 2) + H 2 (****, "вода")
(*) Примітка. Не існує довго в присутності додаткових хімічних і фізичних комбінація атомів кисню O 4 (Фулера). Розпадається на O 4 -> 2 х O 2 (атоми кисню) або вільний атом кисню і озон, при ударі блискавки: O 4 -> O (атом йде вгору на межу атмосфери, озон) + O 3 (вільний озон, накопичується біля поверхні землі, важкий). Вуглецеві фулерени C 5 - шунгіт в Карелії (СНД), лікуються - виходами кисню (фурели і ін). Кращий кисневий санаторій (Карелія, РФ (СНД) - лікуються на півночі Європи, РФ (СНД), Петро I).
(**) Примітка. Найбільш приваблива, алмазоносная кімберлітові трубка ( "Велика Яма" Кімберлі в ПАР, "Мир", "Вдала" в РФ (СНД), "ІнГЗК" в Україні, СНД) - формується чорний вільний газ вуглець C, сірий рідкий графіт C 2 ( пов'язаний) і білий твердий алмаз C 3 або карбонадо (суміш вуглеводів в кристалі). Хімічна активність кімберлітових трубок - вдихання вуглецю С -> СО -> СО2 (задуха, недокрів'я, забирає атом кисню у гемоглобіну крові), роз'їдання графітом (виразки), смерть (алмазіфікація організму, кристали, силікоз). Джерела води типу "Миргород", біла (неможливо напитися - мати питну альтернативу).
(***) Примітка. Отруйний навіть в малих дозах чадний газ СО і вуглець С. Отруєння (непритомність). Отруєння вуглекислим газом CO 2 - паркан вуглекислого газу для потреб промисловості (газована вода, "содова", "американський синдром", типу "Кисловодськ", нарзан, РФ, СНД).
(****) Примітка. Поєднання атомів C 5 * O 7 * H 6. Чадний газ СО з киснем і воднем, небезпечне важко діагностується поєднання. Є "суха" і "мокра" (з водою, пар, кальдера). При виходах сухих вулканічних Гаджі відбирають кисень і водень (сухі кальдери). Другий тип - мінеральна вода, в горах річки і струмки, джерела (при кип'ятінні виходить водень).
- Водень ( "бомба") = 5 х (CO) + 2 х (H 2 O) + H 2 (*****)
(*****) Примітка. У зв'язку з ударом радіоактивного урану і т.п. (болід) відбувається ядерна і термоядерна реакція і формується ізотоп газу водню H 1 і його рідкісні ізотопи - дейтерій H 2 і тритій H 3, а також їхні ядерні та термоядерні похідні - рідкий гелій He 2 (з дейтерію H 2) і літій Li 3 (з тритію H 3). Радіаційні поверхневі ураження активним ядерним ізотопом водню H 1 (шкіра - нейтрон 0), термоядерні опіки He 2 (м'язи, м'які тканини, середня тяжкість - протон +) і поразки Li 3 (обвуглювання і "угліфікація" тіла, вкрай важкі ураження та опіки, "горіння тіла", смерть, тотальне ураження радіацією - електрон -).
Підсумуємо формули за кількістю атомів:
Малахіт Cu 10 (C 5 O 15) * O 10 H 10
Псевдомалахіт Cu 10 (P 4 O 16) * H 4 O 2
Малахіт Cu 5 (C 2 O 7) * O 5 H 5 |
Псевдомалахіт Cu 10 (P 4 O 16) * H 4 O 2 | на фото вище (малахіт + псевдомалахіт)
Малахіт Cu 5 (C 3 O 8) * O 5 H 5 |
Сума атомів - Cu 20 C 5 P 4 O 43 H 14 => Cu 20 + P 4 (білоруський тип)
Примітка. Перетирання кимберлита і мінералів в зоні активного обертання кимберлитовой трубки (смерч в землі). Формується самородна мідь ( "відбиток солей"), 99,3%, в максимально високому кількості, відновлення металевої міді (РФ, СНД) і механічний винесення Фулер фосфору окремо, хімічно активний - болота Білорусі, Європа, СНД. Кімберлітові сепарація - швидке механічне обертання кимберлитовой трубки (торнадо в землі) забезпечує практично повну сепарацію мінералів (РФ, СНД). Механічний розігрів - термальне тепло (недогарок).
Хімічні реакції відновлення міді з солей і відділення фосфору йде в присутності каталізатора азоту N, який в хімічній реакції на фінальному процесі не використовується і вступає у вторинні хімічні реакції з рештою оточенням. Магматичний газ N 2 (ядерні реакції всередині ядра Землі). Високий вміст в атомсфера, хімічно інертний. Додатково виділяється ціаністий газ - отруйний, формуються ціаніди - отруйні сполуки. Безбарвний отруйний газ з гірким запахом, що складається з азоту і вуглецю ціан (CN) 2. Приклад отруйних супутніх сполук наскрізний магматичної кальдери - ціанистий калій KCN, ціанід натрію NaCN (натрієвий теплоносій ядерного реактора АЗС). На основі азоту N.
Залишок атомів - - C 5 - O 43 H 14 => C 5 * O 43 * H 14 (кимберлит обертання)
Каталізатор - N + N 2 + N n (вільний азот, газ, фулерени азоту)
Малахіт - (C 2 O 7) * O 5 H 5 |
Псевдомалахіт - (- O 16) * H 4 O 2 | ціан (CN) 2
Малахіт - (C 3 O 8) * O 5 H 5 |
Ядерна реакція U 92 (уран) -> N 7 (азот) + х 85 (85 од. Таблиці Менделєєва)
Ядерна реакція U 236 (уран) -> N 14 (азот) + х 222 (222 од. Атомарної маси)
U забирає 2 атома кисню O і формує уранініт UO 2, настуран UO 2 * n (H 2 O)
Нестійкий термальний уран U 3 O 8 також небезпечний, чим дихати (забирає кисень) 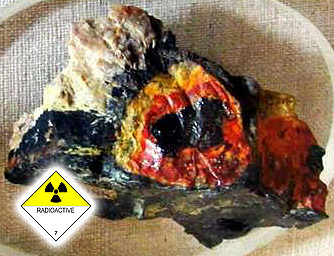 Приклад близькості кимберлитовой трубки третього типу - уранініт, Гумма по уранініта (Північна Карелія, РФ, Європейська частина Росії, СНД). Його викидає на поверхню кімберлітові трубка - на зразок земляного торнадо (смерчу, тромбу). Родовища урану - Володарськ-Волинські пегматити, Житомирська обл. заходу України (СНД) і Луганська область України (СНД), Крим (СНД). Економіці присвячений "Капітал" (К. Маркс).
Приклад близькості кимберлитовой трубки третього типу - уранініт, Гумма по уранініта (Північна Карелія, РФ, Європейська частина Росії, СНД). Його викидає на поверхню кімберлітові трубка - на зразок земляного торнадо (смерчу, тромбу). Родовища урану - Володарськ-Волинські пегматити, Житомирська обл. заходу України (СНД) і Луганська область України (СНД), Крим (СНД). Економіці присвячений "Капітал" (К. Маркс).
Це - кімберлітові трубки, в яких йде найактивніша ядерна реакція, причому чим глибше в тіло звужується на зразок морквини тіло кимберлитовой трубки (кимберлита), тим вище радіоактивний фон кимберлита. Страшний видув газу з тіла кимберлитовой трубки (т.зв. "лазерний"). "Світ" (Якутія, РФ, СНД).
На фото - повна псевдоморфоза по різнобарвному турмаліну ельбаїти (форма). Схоже на ельбаітоподобний дравіт-шерл (турмалін), але потрібен дозиметр. Від 18 мілірентген / год - зупинка, від 24 мілірентген / год - короткострокове перебування, від 32 мілірентген / год - покинути. Від 100 мілірентген / год - смерть. Знамениті уранові кімберлітові рудники і копальні. Приклад радіоактивного викиду - сел. Новогорний (РФ, СНД), 1987-1989 г, 2 рентгена / год.
Особливості кімберлітів описаних типів (на прикладі ураново-малахітово-псевдомалахітового типу з активним викидом кальдери) - важко дихати, не вистачає кисню для дихання, отруєння вуглецем, чадним і вуглекислим газом, отруєння киснем (чистий, отрута) і воднево-азотні проблеми атомсфера. Падіння рівня атомсфера над кимберлитом, горстово-скидний структури воронкоподібного обертання кимберлита в землі (і яма в космосі, стратосфера), видув газів з землі до "лазерного" ( "променевого") типу, невидимо. Радіоактивно.
Водень, Н (лат. Hydrogenium; а. Hydrogen; н. Wasserstoff; ф. Hydrogene; і. Hidrogeno), - хімічний елемент періодичної системи елементів Менделєєва, який відносять одночасно до I і VII групах, атомний номер 1, атомна маса 1, 0079. Природний водень має стабільні ізотопи - проти або водень (1Н, H 1), небезпечний ядерний дейтерій (2Н, H 2 або D) і прославлений радіоактивний теромоядерний - тритій (3Н, H 3 або Т). Для природних сполук Землі середнє відношення D / Н = (158 ± 2) * 10-6 Рівноважний вміст 3Н на Землі ~ 5 * 1027 атомів.
Водень вперше описав в 1766 р вчений Г. Кавендіш. При звичайних умовах водень - газ без кольору, запаху і смаку. У природі у вільному стані знаходиться в формі молекул Н2. Енергія дисоціації молекули Н2 - 4,776 еВ; потенціал іонізації атома водню 13,595 еВ. Водень - найлегший речовина з усіх відомих, щільність при 0 o С і 0,1 МПа 0,0899 кг / м3; t кипіння-252,6 o С, t плавлення - 259,1 o С; критичні параметри: t - 240 o С, тиск 1,28 МПа, щільність 31,2 кг / м3. Найбільш теплопровідний з усіх газів - 0,174 Вт / (м * К) при 0 o С і 1 МПа, питома теплоємність 14,208 * 103 Дж (кг * К).
Рідкий водень дуже легкий (щільність при -253 o С 70,8 кг / м3) і плинний (в'язкість при -253 o С дорівнює 13,8 сп). У більшості з'єднань водень виявляє ступінь окислення +1 (подібний до лужних металів), рідше -1 (подібний до гідридів металів). У звичайних умовах молекулярний водень малоактивний; розчинність в воді при 20 o С і 1 МПа 0,0182 мл / г; добре розчинний в металах - Ni, Pt, Pd і ін. З киснем утворює воду з виділенням тепла 143,3 МДж / кг (при 25 o С і 0,1 МПа); при 550 o С і вище реакція супроводжується вибухом. При взаємодії з фтором і хлором реакції йдуть з вибухом. Основні сполуки водню: вода Н2О, аміак NH3, сірководень Н2S, метан CH4, гідриди металів і галогенів CaH2, HBr, HCl, органічні сполуки С2Н4, HCHO, CH3OH, парафіни та ін.
Водень - найпоширеніший в природі елемент, зміст його в земній корі 1% (по масі). Головний резервуар водню на Землі - вода гідросфери (11,19%, за масою). Водень - один з основних компонентів природних органічних сполук. У вільному стані присутній у вулканічних та інших природних газах, в атмосфері (0,0001%, за кількістю атомів). Становить основну частину маси Сонця, зірок, міжзоряного газу, газових туманностей. В атмосферах планет присутній у формі Н2, CH4, NH3, Н2О, CH, NHOH і ін. Входить до складу корпускулярного випромінювання Сонця (потоки протонів) і космічних променів (потоки електронів).
Сировина для промислового отримання водню - кимберліти, гази нафтопереробки, природні гази, продукти газифікації вугілля і ін. Основні способи отримання водню: реакція вуглеводнів з водяною парою, неповне окислення вуглеводнів киснем, конверсія окису вуглецю, електроліз води. Водень застосовують для виробництва аміаку, спиртів, синтетичного бензину, соляної кислоти, гідроочищення нафтопродуктів, різання металів воднево-кисневим полум'ям. Водень - перспективне газоподібне пальне (NASA). Дейтерій і тритій знайшли застосування в атомній енергетиці (АЕС). За матеріалами: http://www.mining-enc.ru
 ВОДА (а. Water; н. Wasser; ф. Eau; і. Agua) - поширене в природі найпростіше, стійке в звичайних умовах стійке хімічна сполука водню з киснем, Н2О (11,19% водню і 88,81% кисню, по масі); безбарвна рідина (в товстих шарах - блакитного кольору від водрод, ефект р. Волга, РФ (СНД), і зеленуватого кольору - море, мідь і золото) без запаху і смаку. Коричнева - бітум (р. Дон). Воді належить найважливіша роль в геологічній історії Землі і виникнення життя, в формуванні фізичної та хімічної середовища, клімату і погоди. Вода - обов'язковий компонент практично всіх технологічних процесів (гідравліка, з 1969 р - на кімберлітах).
ВОДА (а. Water; н. Wasser; ф. Eau; і. Agua) - поширене в природі найпростіше, стійке в звичайних умовах стійке хімічна сполука водню з киснем, Н2О (11,19% водню і 88,81% кисню, по масі); безбарвна рідина (в товстих шарах - блакитного кольору від водрод, ефект р. Волга, РФ (СНД), і зеленуватого кольору - море, мідь і золото) без запаху і смаку. Коричнева - бітум (р. Дон). Воді належить найважливіша роль в геологічній історії Землі і виникнення життя, в формуванні фізичної та хімічної середовища, клімату і погоди. Вода - обов'язковий компонент практично всіх технологічних процесів (гідравліка, з 1969 р - на кімберлітах).
Ізотопний склад води. У зв'язку з існуванням двох стабільних ізотопів у водню 1Н (H 1) і 2Н, D (H 2), зазвичай позначаються Н і D (дейтерій), і трьох у кисню (16о, 17О і 18О) відомо 9 ізотопних різновидів води. Особливий інтерес представляє важка вода D2О. Фізичні властивості води і їх аномалії визначаються тим, що її молекули об'єднуються в комплекси водневими зв'язками (кимберлит уранового і ііного типу). Існує ряд гіпотетичних структурних моделей води, що вимагають подальшого уточнення.
Структура води відрізняється нестійкістю різного характеру, тому що воднева зв'язок приблизно в 10 разів сильніше звичайного міжмолекулярної взаємодії (кут між хімічними зв'язками 104 o 27 ') - можливе приєднання атомів вуглецю C і формування спорадичних органічних сполук. Структура води залежить від характеру і концентрації домішок, присутніх в ній в іонної, молекулярної і фулерной (об'ємної, сетчатообразной) формах. Різні іони, молекули розчинених газів можуть змінювати структуру води, наприклад, дрібні атоми гелію і молекули водню можуть поміщатися в хімічній структурі води без порушення її водневих та інших зв'язків.
Розподіл електронної щільності в молекулі води таке, що створюються 4 полюси зарядів: 2 позитивних, пов'язаних з атомами водню, і 2 негативних, пов'язаних з електронними хмарами необобществленних пар електронів атома кисню. Зазначені полюси зарядів розташовуються в вершинах тетраедра. Завдяки цій полярності вода має дипольний момент (1,86 D). Кристалічна структура звичайного льоду гексагональна, "пухка" (водень), в ній багато "порожнеч" (при щільній "упаковці" молекул води в кристалах льоду його щільність склала близько 1600 кг / м3). У рідкої воді притаманна льоду зв'язок кожної молекули Н2О з чотирма сусідніми ( "ближній порядок") в значній мірі зберігається; проте "рихлість" структури при плавленні льоду зменшується, молекули "далекого порядку" потрапляють в "порожнечі", що веде до зростання щільності води.
Багато фізичні властивості звичайної води (розчин) виявляють істотні аномалії. Щільність води досягає максимального значення 1000 кг / м3 при +3,98 o С; при подальшому охолодженні вона зменшується, а при замерзанні стрибкоподібно падає (присутній кімберлітових водень - каталізатори, формування дендритів, твердих розчинів і пухких мас), тоді як у інших речовин кристалізація супроводжується збільшенням щільності (без домішок).
Вода здатна до значного переохолодження, тобто може залишатися в рідкому стані нижче температури плавлення (навіть при -30 o С) - дистильована, без домішок сторонніх зародкових центрів кристалізації. В'язкість води, з ростом тиску зменшується, а не підвищується, як у інших рідин. Стисливість води вкрай невелика і з ростом температури зменшується. Деякі аномалії слабшають у міру мінералізації води і навіть зникають в насичених розчинах. Властивості води можуть значно змінюватися в залежності від природних умов, що існують у природі, або штучно створюваних (дія температури і тиску, магнітних полів).
Хімічні властивості води в звичайних умовах. Вода - досить стійке з'єднання, розпад молекул Н2О стає помітним лише вище 1500 o С. Вода взаємодіє з багатьма основними і кислотними оксидами, утворюючи відповідно підстави і кислоти. Приєднання води до молекул ненасичених вуглеводнів лежить в основі промислового способу отримання спиртів, альдегідів, кетонів. Вода бере участь у багатьох хімічних процесах як каталізатор. Так, взаємодія лужних металів або водню з галогенами, багато окислювальні реакції не йдуть у відсутності хоча б незначних кількостей води.
Гази (водень, гелій та інші кімберлітові компоненти) досить добре розчиняються у воді, якщо здатні вступати з нею в хімічні взаємодії (аміак, сірководень, сірчистий газ, двоокис вуглецю). Інші гази менш розчинні у воді. При зниженні тиску і підвищенні температури (до 80 o С) розчинність газів у воді, зменшується. Багато гази при низьких температурах і підвищенні тиску не тільки розчиняються у воді, але і утворюють кристалогідрати.
Вода - слабкий електроліт (літій і т.п.), дисоціюють за рівнянням Н2O <=> H + + OH-, причому кількісною характеристикою електролітичноїдисоціації води служить іонний добуток води: Кв = [Н +] [OH-], де [Н +] і [OH-] - концентрація відповідних іонів в г-іон / л; Кв становить 10-14 (22 o С) і 72 * 10-14 (100єС). Вода розчиняє безліч кислот, підстав, мінеральних солей. Такі розчини проводять електричний струм завдяки дисоціації розчинених речовин з утворенням гідратованих іонів.
Багато речовин при розчиненні в воді вступають з нею в реакцію обмінного розкладання, називається гідролізом. З органічних речовин у воді розчиняються ті, які містять полярні групи (-OH, -NH2, -COOH і ін.) І мають не дуже велику молекулярну масу. Сама вода добре розчинна (або змішується в усіх відношеннях) в обмеженій кількості органічних розчинників. Однак у вигляді незначної домішки до органічних речовин вода присутня практично завжди і здатна різко змінювати фізичні константи останніх. У природі вода зустрічається у вигляді розчинів.
Вода в природі. Природна вода є своєрідним мінералом, що характеризується непостійним хімічним складом, наявністю різноманітних домішок, що змінюють її властивості, і служить об'єктом видобутку, переробки і використання в величезних кількостях (близько 3 * 1012 м3 / рік). Океани, моря, озера, водосховища, річки, підземні води, ґрунтова волога утворюють водну оболонку (Гідросфера). В атмосфері вода знаходиться у вигляді пари, туману і хмар, крапель дощу і кристалів снігу.
У криолитозоне прісні і солонуваті підземні гравітаційні води знаходяться в вигляді підземного льоду, обумовлюючи існування мерзлих порід. Підземні льоди в мерзлих породах (особливо в дисперсних) змінюють їх фізичні властивості (різко підвищують механічну міцність, зменшують водопроникність і т.д.). Солоні підземні води і розсоли в криолитозоне мають негативні температури і відчувають при їх коливаннях зміни в складі.
У земній корі міститься, за різними оцінками, від 1 до 1,3 млрд. Км3 води. При цьому запаси прісних (слабомінералізованних) вод досить обмежені, а солоні води - джерела мінеральних компонентів типу галит (NaCl - кухонна сіль) і т.п .. Значна кількість води в земній корі знаходиться в зв'язаному стані, входячи до складу деяких мінералів і гірських порід (гіпс, гідратованих форми кремнезему, гідросилікати і ін.). Великий комплекс Мена обсяг каменів і мінералів (вода в пустелі і т.п.).
Конституційна (H2O <=> (OH-) + (Н +)) вода знаходиться в кристалічній решітці мінералів у вигляді іонів OH-, рідше - Н +, тобто утворюється при механічному і іншому (хімічному, електричному - іонному і радіаційному) руйнуванні кристалічної решітки будь-якого мінералу. Кристаллизационная вода займає певні місця в структурі решітки мінералу у вигляді молекул Н2О. Частина кристалізаційної води, що виділяється без руйнування решітки і поглинається мінералом при зміні зовнішніх умов (нагрівання-охолодження), називається цеолітної. Молекули адсорбційної води пов'язані з поверхнею мінеральних кристалів, утворюють гігроскопічний шар (в мінералах шаруватої структури містяться міжплощинні шари). У значних кількостях адсорбційна вода присутня в твердих колоїдах (опали і ін.). Вода, що заповнює тонкі канальці в грунті, породі, називається гігроскопічною (капілярної). Розрізняють вільну воду, що заповнює порожнечі, тріщини і переміщається під дією сили тяжіння, нагріву батолітов, механічної та радіаційної хімії кімберлітів і ін.
Величезні кількості води (13-15 млрд. Км3) зосереджені в мантії Землі (викид через магматичні кальдери). Вода, що виділялася з мантії в процесі внутрішнього розігрівання Землі на ранніх стадіях її розвитку, за сучасними поглядами, сформувала гідросферу. Щорічне надходження води з мантії і магматичних вогнищ становить близько 1 км3 (ювенільні води). Є дані про те, що вода, хоча б частково, має космічне походження (викиди Сонця, планет, наднових і квазарів): протони, які прийшли в верхню атмосферу від Сонця та інших зірок, захопивши електрони, перетворюються в атоми водню, які, з'єднуючись з атомами кисню, дають воду. Всі води Землі постійно взаємодіють між собою, а також з атмосферою, літосферою і біосферою. Вода - активний фактор ендогенних і екзогенних геологічних процесів, з водою тісно пов'язані процеси формування родовищ і мінералообразованіе.
У природних умовах кількісний склад домішок змінюється в залежності від походження води і геологічних умов. При концентрації солей до 1 г / кг воду вважають прісної, до 25 г / кг - солоноватой, понад - солоної. Найменш мінералізованими водами є атмосферні опади (в середньому близько 10-20 мг / кг), потім прісні озера і річки (50-1000 мг / кг) - хоча солоні є. В г. Харьков, Україна, СНД був літній солоний дощ - 2010 г. (водяні торнадо). Солоність океану коливається близько 35 г / кг; багато моря мають меншу мінералізацію (Чорне море - 17-22 г / кг, приплив води р. Дон, Балтійське море - приплив води р. Нева, 8-16 г / кг, Каспійське море - приплив води р. Вовка 11-13 г / кг - по типу Водоспад Мітчелл, комплексний водоспадний кимберлит з Патер).
Мінералізація підземних вод поблизу поверхні в умовах надмірного зволоження становить до 1 г / кг, в посушливих умовах до 100 г / кг; в глибинних артезіанських басейнах мінералізація води коливається в широких межах. Максимальні концентрації солей спостерігаються в соляних озерах (до 300 г / кг) і глубокозалегающих підземних водах (до 600 г / кг). У прісних водах переважають іони HCO3-, Ca2 + і Mg2 +. Зміст у воді іонів Ca2 + і Mg2 + визначає її жорсткість. У міру збільшення загальної мінералізації зростає концентрація іонів SO42-, Cl-, Na + і К +. У високомінералізованих водах (м Миргород, Полтавська обл., Україна, СНД та ін.) Переважають іони Cl- і Na +, рідше Mg2 + і рідко Ca2 +. Інші елементи містяться в дуже малих кількостях, хоча майже всі природні елементи періодичної системи знайдені в природних мінеральних кімберлітових водах.
Першоджерелами солей природних вод є речовини, які утворюються при хімічному вивітрюванні вивержених порід (Ca2 +, Mg2 +, Na +, К + і ін.) І виділяються на протязі всієї історії Землі з її надр (CO2, SO2, HCl, NH3 та ін.). Від розмаїття складу цих речовин і умов, в яких відбувалося їх взаємодія з водою, залежить склад води, на вивченні якого засновані гідрогеохімічні пошуки родовищ корисних копалин. Велике значення для складу води має і вплив живих організмів.
З розчинених газів в природних водах присутні азот, кисень, двоокис вуглецю, інертні гази, сірководень і вуглеводні. Газонасиченість підземних вод змінюється від n * 10 до n * 103 см3 / л. Кількість розчиненого газу прямо пропорційно тиску газу або парціальному тиску в суміші газів. При температурі до 100 o С спостерігається зворотна залежність розчинності газів у воді, при температурі вище 100 o С пряма. Газонасиченість води залежить також від величини мінералізації, збільшення якої знижує розчинність газів. Найбільш поширеними газами, розчиненими в підземних водах, є CO2, N2, CH4. Рідше і в менших кількостях розчинені О2, Н2S, Н2, важкі вуглеводні, інертні гази та ін. Спостерігається зональний розподіл газів в підземній гідросфері по вертикалі (зверху вниз): О2 N2 N2 Н2S - CO2 - CH4 - N2 CH4 - N2 (або N2 - CH4) CH4 - CO2 - CH4 Н2S - CO2 - CH4 (в порядку переваги).
Концентрація органічних речовин невелика - в середньому в річках близько 20 мг / л, в океані близько 4 мг / л. Виняток становлять води болотних і нафтових родовищ і води, забруднені промисловими і побутовими стоками, де кількість їх буває вище. Якісний склад органічних речовин надзвичайно різноманітний і включає різні продукти життєдіяльності організмів, що населяють воду, і сполуки, що утворюються при розпаді з їх залишків.
При дослідженнях закономірностей формування і поширення природних вод, оцінці можливостей їх використання (в питних, господарсько-технічних, промислових, іригаційних, бальнеологічних та ін. Цілях), гидрогеохимических пошуках родовищ (нафти, газу, поліметалів, Br, I, В і т. д.) проводять їх аналіз. У водах визначають: фізичні та органолептичні властивості (температуру, колір, смак, запах, мутність, прозорість, щільність, електропровідність); вміст розчинених мінеральних, органічних, радіоактивних речовин, вільних газів; різні показники (pH, Eh, жорсткість, окислюваність, агресивність та ін.); ізотопний і мікробіологічний склад. Вид і методи аналізів визначаються метою досліджень і необхідною точністю. При гидрогеохимических пошуках руд визначають мікрокомпоненти (Cu, Pb, Sn, Ag, Mo, Be, Rb, Cs, Mn, Zn і ін.); при пошуках і дослідженнях нафти - органічні речовини (кислоти, ароматичні вуглеводні, феноли та ін.), гази, індикаторну мікрофлору; при вивченні мінеральних вод - специфічні компоненти (As, Br, I, Fe, органічні речовини і ін.), газовий склад (CO2, H2S, Н2, О2, Rn, N2, CH4); при дослідженнях для водопостачання, санітарного контролю води - забруднюючі і токсичні (Pb, As, Se, Sr та ін.) речовини, бактеріологічні показники; при оцінці технічної властивостей води - обесцвечіваемость, коагуліруемость, корозійні властивості, фільтрованість.
Воду аналізують методами аналітичної хімії: титриметричних і інструментальними (колориметрия, фотометрія полум'я, фотоколориметрія, спектрофотометрія, потенціометрія, радіометр, хроматографія та ін.). Бактеріологічні аналізи виконують методами прямого рахунку на мембранних фільтрах і ін. Для забезпечення максимальної схоронності складу води при аналізах розроблені правила відбору, попередньої обробки та консервації (підкислення, хлороформірованіе, охолодження та ін.) Проб. Лімітуються терміни зберігання проб води до аналізу. Для аналізу води з малим вмістом компонентів застосовують концентрацію, екстракцію та ін.
Застосування води. Неможливо вказати інша речовина, яке б знаходило настільки різноманітне і широке застосування. Вода - хімічний реагент, який бере участь у виробництві кисню, водню, лугів, кислот, спиртів, альдегідів, гашеного вапна і ін. Вода використовується як технологічний компонент для варіння, розчинення, розведення, вилуговування, кристалізації і т.д. Воду застосовують у численних виробничих процесах. У техніці вода служить енергоносієм (гідроенергетика), теплоносієм (нагрівання, охолодження), робочим тілом (парові машини). Природні води вживають для питного і господарського водопостачання, теплопостачання (Термальні води), в бальнеології (Мінеральні води), для вилучення з них цінних компонентів (Розсоли) і т.п. При виробництві гірських робіт воду використовують для транспортування гірських порід і корисних копалин в шахтах і кар'єрах (Гідравлічний транспорт), для передачі тиску і потужності при бурінні забійні двигуни, а також для промивання свердловин і ін. При розробці обводнених родовищ корисних копалин комплексно вирішуються питання водозащити гірничих виробок, водозниження, водовідливу, бараж, дренажу, захисту обладнання від дії агресивних вод і використання води (наприклад, для гідравлічного руйнування гірських порід, гідравлічного закладання виробленого простору, пилоподавлення, замулювання, протипожежних заходів, заводнення родовищ нафти). Із застосуванням води проводяться збагачення корисних копалин, їх сортування і т.п.
Зміна властивостей води (магнітна обробка - видалення магнітами феррометалліческіх, полуорганіческіх, органічних та інших реагують на магнітне поле домішок) використовується для поліпшення процесів флотації, очищення води від суспензій багатьох типів і ін. В результаті промислового використання води виникає необхідність введення водооборотних систем, безстічних технологій і очищення води. При скиданні стічних вод у природні водойми очищення проводиться до норм гранично допустимих концентрацій розчинених речовин і проводяться заходи з охорони гідросфери, охорони підземних вод (див. Очищення вод). У СНД споживання водних ресурсів регламентується Основами водного законодавства СНД і держав співдружності. Існують також міжнародні угоди по охороні водних ресурсів в рамках РЕВ та інших міжурядових організацій. За матеріалами: http://www.mining-enc.ru
- Гетчелл - "Нью-Альмаденская обманка" - арсенід і сульфід сурми (сучасна сульфосолей)
- Сурма - отруйний метал (напівметал) , широко використовуваний в металургії, медицині та техніці
- Цирконій - рідкісний і нерозповсюджений метал і найнебезпечніший дорогоцінний камінь в оксиді і солі
- Золото - жовтий небезпечний і отруйний метал сучасних точних цифрових і кабельних технологій
- Сірка - золотисто-жовте токсичну речовину і ознака активної вулканічної діяльності
- Кадмій - нерозповсюджений токсичний невідомий широкому колу людей сріблястий метал
- Свинець - отруйний сірий імітатор металевого срібла і токсична металева обманка
- Миш'як - класичний отрута середньовічних і сучасних отруйників і ліки в медицині
Отруйні і радіоактивні небезпечні камені і мінерали
** - Отруйні камені і мінерали (обов'язкова перевірка в хімлабораторії + явне вказівку на отруйність)
** - Радіоактивні камені і мінерали (обов'язкова перевірка на штатному дозиметрі + заборона на відкритий продаж в разі радіоактивності понад 24 мілірентген / год + додаткові заходи захисту населення)
Каталог мінералів і самоцвітів світу за групами
** - Отруйні камені і мінерали
** - Радіоактивні камені і мінерали


Коментарі
Коментуючи, пам'ятайте про те, що зміст і тон Вашого повідомлення можуть зачіпати почуття реальних людей, проявляйте повагу та толерантність до своїх співрозмовників навіть у тому випадку, якщо Ви не поділяєте їхню думку, Ваша поведінка за умов свободи висловлювань та анонімності, наданих інтернетом, змінює не тільки віртуальний, але й реальний світ. Всі коменти приховані з індексу, спам контролюється.