|
Начало раздела Производственные, любительские Радиолюбительские Авиамодельные, ракетомодельные Полезные, занимательные |
Хитрости мастеру Электроника Физика Технологии Изобретения |
Тайны космоса Тайны Земли Тайны Океана Хитрости Карта раздела |
|
| Использование материалов сайта разрешается при условии ссылки (для сайтов - гиперссылки) | |||
Навигация: => |
На главную/ Каталог патентов/ В раздел каталога/ Назад / |
|
ИЗОБРЕТЕНИЕ
Патент Российской Федерации RU2040565
![]()
СПОСОБ ИЗВЛЕЧЕНИЯ РУБИДИЯ ИЗ РАСТВОРОВ СЛОЖНОГО ХИМИЧЕСКОГО СОСТАВА
Имя изобретателя: Глушанкова И.С.; Колесова С.А.; Баландина Л.В.; Вольхин В.В.
Имя патентообладателя: Пермский государственный технический университет
Адрес для переписки:
Дата начала действия патента: 1991.02.19
Использование: получение солей редких щелочных металлов. Сущность изобретения: рубидий из растворов сложного химического состава сорбируют на ферроцианидный сорбент, обрабатывают сорбент с извлечением Rb в раствор в две стадии: на первой стадии раствором хлора во фторсодержащем органическом растворителе, в качестве которого используют фторированные жидкости Ф-12, Ф-13, на второй концентрированным водным раствором одноатомных спиртов, в качестве которых используют этиловый с концентрацией 85 96% об. или изопропиловый с концентрацией 80 88% об. получают хлорид рубидия упариванием раствора с отгонкой спиртов и повторным их использованием.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение относится к способам получения солей редких щелочных металлов и может быть использовано в технологии получения солей рубидия.
Известен сорбционный способ извлечения ионов рубидия из растворов сложного химического состава с высоким содержанием солей щелочных и щелочноземельных металлов с использованием в качестве сорбентов ферроцианидов (гексацианоферратов) переходных металлов Ni(II), Cu(II) с последующей десорбцией ионов рубидия и переработкой элюатов известными методами (упариванием или осаждением в виде малорастворимого соединения) [1,2]
Известно, что ферроцианиды переходных металлов селективно извлекают ионы рубидия из различных по составу растворов, при этом достигаются высокие коэффициенты разделения ионов Rb+ и K+, Rb+ и Na+ (Kp 103) [2,3]
Однако, широкое применение сорбционной технологии получения солей рубидия сдерживается отсутствием достаточно эффективного способа десорбции ионов Rb+ из состава ферроцианидов, что одновременно создает трудности для получения солей рубидия реактивной квалификации.
Известны ионообменные способы десорбции ионов Rb+ и других щелочных металлов из состава ферроцианидных сорбентов с помощью хлоридов или нитратов аммония [3] Однако, эти способы малоэффективны. Известны и способы десорбции ионов щелочных металлов и таллия (I) из состава ферроцианидов с применением окислителей. В качестве окислителя используется высококонцентрированные растворы азотной или серной кислот [4]
Наиболее близким к предлагаемому техническому решению (прототипом) является способ выделения рубидия, включающий сорбцию рубидия на ферроцианидном сорбенте и последующую обработку сорбента с извлечением рубидия в раствор, с получением раствора хлорида рубидия [3]
Однако в результате десорбции образуются значительные объемы элюатов с низкой концентрацией рубидия, что приводит к высоким энергозатратам при переработке растворов с целью получения хлорида рубидия. Кроме того, для получения достаточно чистой соли необходимо предварительное разделение ионов Rb+ и Na+, что и усложняет технологию.
Цель изобретения повышение степени извлечения рубидия в продукт и снижении энергозатрат.
Цель достигается за счет десорбции ионов Rb из состава ферроцианида путем обработки последнего раствором хлора в органическом растворителе. Выделившийся хлорид рубидия переводят в раствор с помощью концентрированных водных растворов низкокипящих одноатомных спиртов с последующей их отгонкой упариванием и получением высококонцентрированных растворов соли рубидия. Отогнанный спирт вторично используется для десорбции рубидия в следующем цикле работы сорбента.
В качестве растворителя хлора выбраны фторорганические жидкости, например Ф-12, Ф-13, которые отвечают следующим требованиям: низкая летучесть, негорючесть, высокая химическая инертность (стойкость к окислителям), низкая растворимость в воде и спиртах, нетоксичность. Насыщение хлором фторорганических жидкостей осуществляли известным способом, пропуская газообразный хлор через растворитель. При комнатной температуре равновесная концентрация хлора в Ф-12, Ф-13 составляет 0,5-0,7 М. Высокая концентрация хлора в растворе позволяет значительно сократить объем элюента, необходимого для десорбции ионов рубидия из состава ферроцианидов. Извлечение выделенного из состава сорбента хлорида рубидия осуществляют водой или растворами спиртов. Хлорид рубидия растворяется в одноатомных спиртах (метиловом, этиловом, пропиловом, изопропиловом и др.) и их водных растворах.
С целью снижения энергозатрат на упаривание элюатов предлагается проводить десорбцию хлорида рубидия RbCl растворами этилового или изопропилового спиртов, которые выбраны с учетом низкой температуры кипения и невысокой токсичности. Затраты тепла на получение 1 кг соли рубидия упариванием элюатов рассчитывали по формуле

Пример 1. 5 г ферроцианидного сорбента, брутто-формула которого К0,92Cu1,54[Fe(CN)6] 4,9SiO2, загружали в ионообменную колонку диаметром 0,7 см и высотой слоя сорбента 20 см и проводили сорбцию Rb из модельного раствора, содержащего хлориды рубидия и калия с соотношением Rb+:K+1:150 и концентрацией Rb 0,2-0,25 г/л (2,34 . 10-3-2,9 . 10-3) при скорости пропускания раствора 2-3 колоночных объема/ч. Полная ионообменная емкость сорбента по иону Rb составила 0,82-0,88 ммоль/г сорбента. При этом коэффициенты разделения ионов Rb+ K+ достигал 5.103 5,5 .103.
Для получения соли рубидия реактивной квалификации проводилась избирательная десорбция К+ и Rb+.
Десорбцию ионов калия из состава ферроцианида осуществляли 1 М раствором соляной кислоты. При пропускании 8-10 колоночных объемов (КО) элюента достигается практически полная десорбция К+, при этом извлечение ионов Rb составляет менее 1%
Измерение концентрации ионов рубидия и калия осуществляли атомно-абсорбционным методом.
Для извлечения рубидия из состава сорбента последний обрабатывали 0,7 М раствором хлора во фторированной жидкости Ф-13 путем пропускания его через ионообменную колонку со скоростью 3-4 Ко/ч. Полноту окисления сорбента контролировали по расходу хлора. Концентрацию хлора в органическом растворителе измеряли титриметрическим методом. Для полного окисления ферроцианида требовалось 2 КО раствора хлора. Затем через сорбент для выделения образованного хлорида рубидия пропускали воду со скоростью 4-5 КО/ч. Пробы элюата на анализ отбирали фракциями по 20 мл. Для полной десорбции ионов Rb требовалось 8 КО. Первая фракция элюата с максимальной концентрацией основного компонента перерабатывалась на готовый продукт, а следующие фракции собирались и использовались повторно для десорбции ионов Rb в следующих циклах.
После окончания процесса десорбции сорбент промывался 2-3 КО воды, регенерировался известным способом и использовался в следующем цикле сорбции рубидия [4]
Концентрация хлорида рубидия в первой фракции элюата и затраты тепла на ее упаривание представлены в таблице.
Пример 2. Сорбцию ионов Rb+ и десорбцию ионов К+ провели согласно примеру 1. Для перевода RbCl в элюат через колонку пропускали этиловый спирт с концентрацией 96 об. Для полной десорбции RbCl потребовалось 12 КО спирта. Концентрация RbCl в первой фракции элюата и приближенные затраты тепла на получение 1 кг соли рубидия представлены в таблице.
Пример 3. Сорбцию ионов Rb+ и десорбцию ионов К+ провели согласно примеру 1. Затем сорбент обработали 0,4 М раствором хлора во фторированной жидкости Ф-13. Расход элюента, необходимый для полного окисления сорбента, составил 3-4 КО. Затем сорбент обрабатывали раствором этилового спирта с концентрацией 84 об. Для полного выделения RbCl пропущено 8 КО элюента. Результаты десорбции представлены в таблице.
Пример 4. Сорбцию ионов Rb+ и десорбцию ионов К+ провели согласно примеру 1. Затем сорбент обрабатывали 0,5 М раствором хлора во Ф-13. Раствор элюента составил 2-3 КО. Затем для извлечения RbCl через колонку пропускали 70 об. раствором этилового спирта, в количестве 6 КО. Результаты по десорбции RbCl представлены в таблице.
Пример 5. Сорбцию ионов Rb+, десорбцию ионов К+, обработку сорбента раствором хлора проводили согласно примеру 1. Десорбцию RbCl осуществляли 100% -ным раствором изопропилового спирта, для полного извлечения RbCl потребовалось 12 КО спирта. Результаты эксперимента представлены в таблице.
Пример 6. Сорбцию ионов Rb+, десорбцию ионов К+, обработку сорбента раствором хлора проводили согласно примеру 1. Для десорбции RbCl через сорбент пропускали 10 КО изопропилового спирта с концентрацией 95% Результаты эксперимента представлены в таблице.
Пример 7. Сорбцию ионов Rb+ и десорбцию ионов K+ провели согласно примеру 1. Затем сорбент обработали 0,5 М раствором хлора во фторированной жидкости Ф-12. Для полного окисления сорбента потребовалось 3 КО элюата. Для извлечения RbCl через колонку пропускали 8 КО 88 об. раствора изопропилового спирта. Результаты эксперимента представлены в таблице.
Пример 8. Сорбцию ионов Rb+, десорбцию ионов К+ и обработку сорбента хлором проводили согласно примеру 1. Затем для извлечения RbCl через колонку пропустили 66 КО 80 об. раствора изопропилового спирта.
Результаты эксперимента представлены в таблице.
Пример 9. Сорбцию ионов рубидия, десорбцию ионов К+ и обработку сорбента хлором провели согласно примеру 1. Затем для извлечения RbCl через колонку пропустили 4 КО 75 об. раствора изопропилового спирта. Результаты эксперимента представлены в таблице.
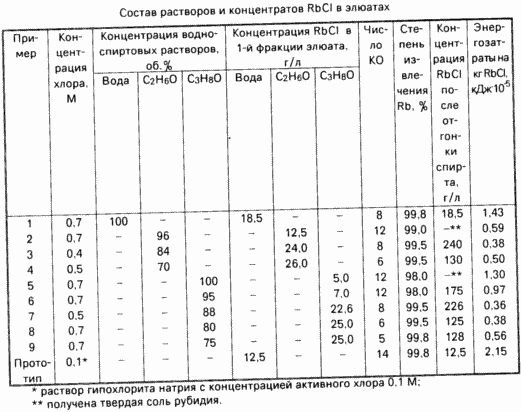
Из приведенных в таблице данных видно, что процесс десорбции ионов рубидия из состава ферроцианидного сорбента и получения соли рубидия упариванием элюатов наиболее целесообразно проводить обработкой ферроцианида 0,5-0,7 М раствором хлора во фторированной жидкости Ф-12 или Ф-13, а затем выделившийся из фазы сорбента хлорид рубидия извлекать 96-85%-ным раствором этилового или 88-80 об. раствором изопропилового спиртов.
Использование воды для извлечения хлорида рубидия из состава сорбента нецелесообразно из-за высоких энергозатрат при получении соли упариванием водных растворов.
Применение менее концентрированных растворов спиртов для десорбции ионов рубидия снижает концентрацию этого иона в растворах полученных после отгонки спирта и увеличивает энергозатраты при их переработке. Использование более концентрированных растворов спиртов малоэффективно из-за низкой растворимости солей рубидия в них.
Предлагаемый способ извлечения рубидия из сложных по составу растворов позволяет по сравнению с прототипом в 1,5-2 раза повысить концентрацию рубидия в элюатах и снизить энергозатраты на получение соли рубидия в 3-6 раз.
ФОРМУЛА ИЗОБРЕТЕНИЯ
1. СПОСОБ ИЗВЛЕЧЕНИЯ РУБИДИЯ ИЗ РАСТВОРОВ СЛОЖНОГО ХИМИЧЕСКОГО СОСТАВА, включающий сорбцию рубидия на ферроцианидном сорбенте и последующую обработку сорбента с извлечением рубидия в раствор с получением хлорида рубидия, отличающийся тем, что, с целью повышения степени извлечения рубидия в продукт и снижения энергозатрат, обработку ферроцианидного сорбента ведут в две стадии, на первой стадии раствором хлора во фторсодержащем органическом растворителе, на второй концентрированным водным раствором одноатомных спиртов с их последующей отгонкой упариванием и повторным использованием.
2. Способ по п.1, отличающийся тем, что в качестве фторсодержащего органического растворителя используются фторированные жидкости Ф-12,Ф-13.
3. Способ по п.1, отличающийся тем, что в качестве одноатомных спиртов используют этиловый с концентрацией 85-96 об. или изопропиловый с концентрацией 80-88 об.
Версия для печати
Дата публикации 15.03.2007гг
Created/Updated: 25.05.2018
 |
|
