| початок розділу
Виробничі, аматорські радіоаматорські Авіамодельний, ракетомодельного Корисні, цікаві |
хитрощі майстру
електроніка фізика технології винаходи |
таємниці космосу
таємниці Землі таємниці Океану хитрощі Карта розділу |
|
| Використання матеріалів сайту дозволяється за умови посилання (для сайтів - гіперпосилання) | |||
Навігація: => |
На головну / Каталог патентів / В розділ каталогу / Назад / |
|
ВИНАХІД
Патент Російської Федерації RU2234954
![]()
СПОСІБ КОМБІНОВАНОГО лікування тютюнопаління
Ім'я винахідника: Сафаєв Р.Д. (RU); Ардашев В.Н. (RU); Пічугін В.А. (RU); Гущин С.В. (RU)
Ім'я патентовласника: Сафаєв Раджаб Давроновіч
Адреса для листування: 115569, Москва, вул. Маршала Захарова, 6, корп.3, кв.165, Р.Д. Сафаеву
Дата початку дії патенту: 2002.12.27
Винахід відноситься до галузі медицини, а саме до наркології. Впливають одночасної комбінацією постійного і змінного струму на гіпоталамо-гіпофізарну надпочічніковую систему організму. При цьому вплив здійснюють методом мезодіенцефальной модуляції з частотою впливає струму 76 Гц, з девіацією частоти 20 Гц, періодом зміни частоти 80 секунд і кроком зміни частоти 1,0 Гц, при співвідношенні величини постійного і змінного струму 2: 3, яку обирають при заданій величині постійного струму в діапазоні 0,07-4,7 мА. Одночасно пацієнт отримує грандаксин в дозі 150-300 мг щодня. Спосіб дозволяє підвищити ефективність лікування.
ОПИС ВИНАХОДИ
Винахід відноситься до медицини, зокрема, комбінованого способу лікування тютюнопаління як поліфункціональної хвороби, що призводить до порушення нормальної фізіологічної функції внутрішніх органів, шляхом заміщення дії нікотину на гіпоталамо-гіпофізарну надпочечниковую систему через вплив на неї струмом і атиповим бензодіазепіновими анксіолітиків, що не викликає синдрому лікарського звикання і залежності у людини.
У літературі відомі різні способи лікування тютюнопаління (Смирнов В.К., 1993). Для всіх способів характерні клінічні етапи збору анамнезу, де з'ясовують причини і різні індивідуальні характеристики куріння, необхідні для адекватного підбору методів лікування (Смирнов В.К., 2000). При підборі рекомендацій необхідно враховувати стадію куріння, а отже, передбачувану:
- Тяжкість абстинентного синдрому;
- підлога;
- Вік;
- Соматичне стан кращого;
- Тип куріння.
Стадія куріння визначається ступенем наростання толерантності до тютюну. Зазвичай виділяють 3 стадії - випадкового (1), звичного (2) і упередженого (3) куріння.
Перша стадія - стаж куріння від 5 до 10 років - в середньому вживається 5 сигарет в день. Куріння випадкове, залежить від ситуації. Курять відчувають лише психологічну залежність від тютюну. Як правило, соматичні захворювання на цій стадії відсутні, можливі лише слабко виражені вегетосудинні зміни. При відмові від куріння абстиненції немає, вегетосудинні зміни оборотні.
Друга стадія - стаж куріння від 10 до 20 років - курять, затягуючись, від 5 до 20 сигарет в день, залежність від сигарет вже почасти фізіологічна, толерантність до тютюну підвищена. На цій стадії у курців відзначається соматична патологія, багато прояви якої ще оборотні. Відмова від куріння супроводжується вираженими симптомами абстиненції.
Третя стадія - стаж куріння більше 20 років - викурюється більше 20 сигарет в день, куріння буває натщесерце, серед ночі. На цій стадії переважає фізіологічна залежність від тютюну, потяг курити непереборно, толерантність висока. Соматоневрологічна патологія зустрічається практично у всіх курців. Відмова від куріння супроводжується симптомами важкої тютюнової абстиненції.
ПІДХОДИ ДО ТЕРАПІЇ ТЮТЮНОВОЇ ЗАЛЕЖНО
Аналіз досліджень, присвяченій питанням терапії хворих тютюновою залежністю, виявляє існуючу закономірність: наявність негативної динаміки кінцевих результатів лікування. Вона проявляється у вигляді прогресуючого збільшення рецидивів куріння в міру збільшення тривалості часу відмови від куріння (Смирнов В.К., 2000). Така тенденція зберігається незважаючи на застосування найрізноманітніших способів лікування куріння тютюну, розроблених в різних країнах світу. До них відносяться способи: з спрямованістю на поступове зменшення кількості нікотину в сигаретах; із застосуванням градуювальних зовнішніх фільтрів; за допомогою селективного виробництва тютюну зі зниженим вмістом нікотину і смолистих речовин або шляхом зменшення кількості викурених сигарет з самоконтролем; з спрямованістю на розробку індивідуальних заходів із застосуванням поетапних лікарських впливів; з спрямованістю на зміну чутливості до тютюнового диму за допомогою рефлексотерапії; з спрямованістю на розробку поведінкових програм з використанням техніки стимулюючого контролю і самоконтролю; з спрямованістю на замісні форми терапії у вигляді прийому коштів, що імітують дію нікотину, що входить до складу тютюнового диму і який на думку дослідників, несе відповідальність за звикання до паління тютюну. До них відноситься жувальна гумка з нікотином (Нікоретте) і нікотин в розчині, нікотин для трансдермального застосування або нікотин-спрей.
Всі вживані в даний час засоби і методи лікування куріння тютюну традиційно поділяються на дві основні форми: форму переважно фармакологічну і нефармакологічні. Основу фармакологічних методів складає застосування алкалоїдів Н-холіноміметичну дії, які мають замінних ефектом. Подібно до нікотину, будучи його конкурентним антагоністом, вони забезпечують витіснення алкалоїду тютюну з його зв'язків з біохімічними субстратами організму, що сприяє зниженню потягу до куріння тютюну. До них відносяться цітізін, лобелін, анабазин (Смирнов В.К., 2000).
Нефармакологічними форма лікування включає в себе способи лікування тютюнової залежності за допомогою голкорефлексотерапії за методикою Ножье або Руднєва. Відомо, що існують обмеження, що мають місце при проведенні рефлексотерапії і трансдермальною терапії при лікуванні тютюнопаління - це наявність у хворих злоякісних новоутворень, гострих інфекційних захворювань, хронічних інфекційних захворювань, органічних захворювань серця і нирок, станів після інфаркту міокарда, декомпенсації органів дихання і кровообігу, алергічні хвороби шкірних покривів.
При 2 і 3 стадіях тютюнової залежності на тлі загальнозміцнюючу терапії (вітаміни, ноотропи) призначаються транквілізатори (феназепам, рудотель, сибазон), малі дози антидепресантів (азафен, амітриптилін) в поєднанні з Нікоретте. В рамках психосоматичної форми тютюнової залежності найбільш ефективним терапевтичним підходом з метою купірування синдрому відміни з'явилася комбінована терапія Нікоретте з транквілізаторами типу феназепаму 1-3 мг, сибазона 10-15 мг, тазепама 10-30 мг на добу, финлепсина до 200 мг на добу; антидепресантами типу азафена 25-75 мг, амитриптилина 25-50 мг, герфонал 25-50 мг, мелипрамина 25-50 мг на добу; нейролептиками типу сонапакса 10-30 мг, френолона 5-15 мг на добу, котрі призначаються диференційовано залежно від переважання тієї чи іншої симптоматики в психічному стані хворих (Смирнов В.К., 1993).
На жаль, багато транквілізатори не вільні від побічних дій - млявість, денна сонливість, м'язова розслабленість, труднощі концентрації уваги, порушення пам'яті, імпотенція і т.д.
В цьому відношенні найбільш вдалим препаратом вибору є грандаксин-2,3-бензодіазепін, який володіє безпекою, відсутністю поведінкової токсичності, поліпшенням якості життя (Вейн А.М. та ін., 1999). Особливостями фармакокінетики і фармакодинаміки є селективне анксіолітичну дію, виражена вегетокоррегірующая активність, відсутність здатності підсилювати дію алкоголю, відсутність здатності викликати звикання і лікарську залежність, поліпшення якості життя пацієнта. Грандаксин відрізняється м'яким дією, підвищує стійкість організму до повторного дії травмуючих психіку факторів, нормалізує сон, має виразний вегетотропние ефект. Грандаксин є атиповим бензодіазепіновими похідним. На відміну від інших похідних бензодіазепінового ряду грандаксин має N (азот) в положенні 2,3, тобто 2,3-бензодіазепін, що визначає його клініко-фармакологічні особливості та більш широке застосування в клініці різних захворювань. З огляду на переваги грандаксина перед іншими препаратами бензодіазепінового ряду, які чітко стимулюють базальну активність гіпоталамо-гіпофізарної надниркової системи (ГГНС), було вирішено використовувати грандаксин як основний препарат при лікуванні тютюнової залежності (Сапронов Н.С., 1998).
Відомі обмеження, що мають місце для проведення рефлексотерапії, відсутні при лікуванні тютюнової залежності методом краніальної електростимуляцією. Широкий діапазон цього терапевтичного методу обумовлений впливом на механізми нейро-гуморально-ендокринної регуляції гомеостазу організму. Відомий спосіб лікування тютюнової залежності стимуляцією лобних і центральних півкуль головного мозку і сосцевидних відростків імпульсними струмами частотою 80-120 Гц, тривалістю імпульсу 50-100 мкс. 6 електродів, змочених фізіологічним розчином, фіксують на шкірних покривах голови над лобовими і центральними областями мозку обох півкуль і на сосцевидних відростках праворуч і ліворуч за допомогою лейкопластиру або еластичного бинта. При цьому метод забезпечує тільки купірування абстинентного синдрому і призначений для скорочення термінів лікування і подовження ремісії, що видно з наведених прикладів (Смирнов В.К. та ін., 1986, Мельникова Т.С. та ін., 1986). Завданням запропонованого способу лікування тютюнопаління як поліфункціональної хвороби, є вплив на гіпоталамо-гіпофізарну надпочечниковую систему одночасної комбінацією постійного і змінного струму за допомогою двох нашкірних електродів через центрально-сагітальній лобно-потиличну область.
Електроди розташовують таким чином: накожний електрод з позитивною полярністю накладають між лобовими буграми і надпереносье по центру лобової області, а накожний електрод з негативною полярністю накладають на потиличну область по центру великого потиличного отвори, при цьому центральна частота струму складає 76 Гц, з девіацією частоти 20 Гц, період зміни частоти 80 секунд, з кроком зміни частоти 1 Гц, при співвідношенні постійного і змінного струму 2: 3, при заданій величині постійного струму в діапазоні 0,07-4,7 мА (мезодіенціфальная модуляція). Форма змінного струму в залежності від клінічної форми захворювання, зумовленого палінням, може бути прямокутної - при хворобах органів системи кровообігу; трапецеидальной - при хворобах нервової системи; складної, що складається з 4 імпульсів тривалістю 200 мкс з періодом проходження 1 мс - при хворобах органів шлунково-кишкового тракту. При важкій нікотинової залежності і патології більш ніж 4 органів різних систем організму додатково впливають на гіпоталамо-гіпофізарну надпочечниковую систему організму атиповим бензодіазепіновими анксіолітиків - грандаксин, що не викликає синдрому лікарського звикання і лікарської залежності, в дозах до 300 мг на добу.
Лікувальний ефект досягається тим, що при описаних параметрах струму і дозах бензодиазепинового анксіолітика відбувається викид нейропептидів ендорфіновий ряду ( ![]() -ендорфін), які стимулюються при попаданні нікотину в кров. Наприклад, висловлювалися міркування про ймовірної ролі нейропептидів у розвитку наркотичної залежності. Більш конкретні уявлення можуть бути суттєвими для фармакотерапії хронічного болю, різних форм залежності і психічних розладів.
-ендорфін), які стимулюються при попаданні нікотину в кров. Наприклад, висловлювалися міркування про ймовірної ролі нейропептидів у розвитку наркотичної залежності. Більш конкретні уявлення можуть бути суттєвими для фармакотерапії хронічного болю, різних форм залежності і психічних розладів.
На культурі клітин гіпоталамуса досліджувалася реакція бета-ендорфінсодержащіх нейронів при внесенні нікотину в культуру протягом 9 днів. Експерименти показали стимуляцію рилізинг бета-ендорфіну при гострому введенні нікотину і десенситизацию ендорфінпродуцірующіх нейронів при хронічній аплікації. При скасуванні нейрони гіпоталамуса різко збільшували секрецію бета-ендорфіну, що тривала 72 години (Aguilamansilla N et al., 1997). Отримані дані та власні спостереження показали, що комбінований вплив описаними нами струмами і грандаксин дають стійкий клінічний результат при лікуванні тютюнової залежності.
МАТЕРІАЛИ І ВИСНОВКИ
приклад 1
На підставі анкетування відвідувачів поліклініки і хворих багатопрофільного госпіталю були відібрані добровольці-курці для проведення дослідження ефективності лікування грандаксин тютюнової залежності. Головним критерієм було власне бажання добровольців, які хотіли кинути курити вперше або які не втратили віру в лікування після невдалих спроб самостійного лікування. Всім курцям-добровольцям були дана інформація про препарат і його дії на організм і на рівні бесіди роз'яснені деякі механізми розвитку тютюнової залежності і способів її лікування. Були обгрунтовано доведені відмінності, переваги і недоліки існуючих методів лікування на основі літературних даних і мета-аналізів із зарубіжної практики за останні 5 років. Всі добровольці відмовилися від групового психотренінгу і гіпнозу і вважали їх неефективними в умовах постійного стресу. Умови дослідження були однакові для всіх учасників, а саме не було лікарського тиску щодо відмови від куріння в примусовому порядку, взаємини будувалися на повній довірі лікаря і своїй вірі в ефективність лікування. Були дотримані всі морально-етичні аспекти дослідження з дотриманням конфіденційності дослідження.
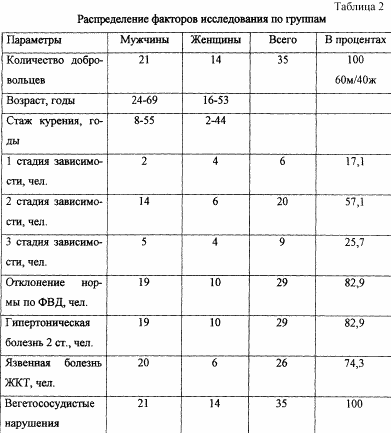
Було відібрано і обстежено 35 курців-добровольців (21 чоловіків і 14 жінок) від 24 до 69 років. Стаж куріння склав від 2 до 55 років. Контрольну групу склали 12 лікарів-добровольців, які перебували в жорстких робочих умовах на амбулаторному прийомі, але ніколи не мали тютюнової залежності (9 жінок і 3 чоловіків). В анамнезі були присутні такі захворювання як гіпертонічна хвороба 2 ступеня, виразкова хвороба шлунково-кишкового тракту і вегето-судинні порушення (див. Таблицю 2).
Для оцінки ефективності лікування комбінованим способом тютюнової залежності використовували такі методи:
1. Збір повного клінічного анамнезу курця.
2. Анкетування в умовах багатопрофільного госпіталю і амбулаторно в поліклініці.
3. Функціональні методи дослідження - ЕКГ, функція зовнішнього дихання, добове моніторування артеріального тиску.
4. Персональний 10-денний щоденник пацієнта.
5. Телефонне опитування і бесіда з добровольцями на амбулаторному прийомі через місяць після проведеної терапії, контрольні функціональні дослідження і вимірювання артеріального тиску.
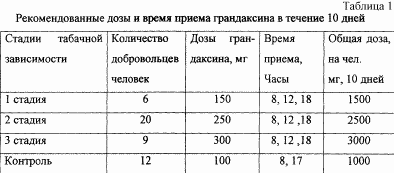
Всі досліджувані отримували по 10 процедур мезодіенціфальной модуляції по запропонованому способу щодня протягом 30 хвилин. Грандаксин використовували в формі таблеток по 50 мг. Для всіх груп останній прийом грандаксина було рекомендовано приймати за 4 години до сну. У персональних щоденниках пацієнтів відзначалися зміни стану по 22 пунктам.
Контрольній групі грандаксин призначався в дозах 100 мг у два прийоми - о 8 годині і 17 годин відповідно.
Група добровольців з 1 стадією тютюнової залежності отримувала по 150 мг грандаксина - 8 годин, 12 годин і 18 годин відповідно.
Група добровольців з 2 стадією тютюнової залежності отримувала грандаксин в дозах 250 мг: 8 годин ранку - 50 мг, 12 годин і 18 годин - по 100 мг відповідно.
Група добровольців з 3 стадією тютюнової залежності отримувала грандаксин в дозах 300 мг: 8 годині ранку - 100 мг, 12 годин - 100 мг, 18 годин - 100 мг відповідно.
Для всіх груп незалежно від форми тютюнової залежності, включаючи контрольну групу, призначався курс лікування в 10 днів (таблиця 1). Для зміцнення лікувального ефекту через 30 днів після комбінованого способу лікування тютюнової залежності використовували метод транскраніальної мезодіенціфальной модуляції по 30 хвилин від 4 до 10 сеансів. У таблиці наведено дані лікування.
РЕЗУЛЬТАТИ І ВИСНОВКИ
Ефективність лікування комбінованим способом підтверджували дані персональних щоденників та інструментальні дослідження артеріального тиску і функції зовнішнього дихання. При клінічному огляді і зборі анамнезу після лікування спостерігали такі показники - порушення сну, емоційні порушення, порушення шлунково-кишкового тракту, пітливість, бажання курити, ставлення до оточуючих кращим, самооцінка стану здоров'я.
Для всіх добровольців-курців було характерно відсутність самого факту синдрому відміни куріння та пов'язаних з цим порушень, таких як зміни в поведінці, надбавка у вазі, більше споживання їжі. Кожен знав, що він може закурити, але в той же час кожен знав, що процес лікування полягає не в блокуванні тютюнової залежності, а в заміщенні куріння. У зв'язку з цим кожному пацієнтові був застосований індивідуальний підхід виходячи з його клінічного анамнезу і, знаючи можливу стадію тютюнової залежності (абстиненції), була розрахована середня доза щоденного прийому грандаксина (див. Таблицю 1).
За 10-денний період лікування були відзначені такі позитивні тенденції: стабілізація пульсу, артеріального тиску, впевненість в собі, поступове зниження кількості викурених сигарет на 4-6 день лікування, усвідомлене відчуття контролю утримання від куріння в компанії курців або в ситуаціях, коли зазвичай доводилося закурювати.
Однак при 3 стадії тютюнової залежності 7 пацієнтам з 9 (3 жінки і 4 чоловіків) довелося додатково провести курс транскраніальної мезодіенціфальной стимуляції гіпоталамо-гіпофізарної системи для збільшення седативного ефекту, що викликається нікотином, тобто стимуляції викиду ![]() -ендорфін в ЦНС і кровотік для зменшення абстинентного синдрому (додаток). Для цих хворих були характерні наступні параметри: стаж куріння більш ніж 30-35 років, кількість викурених сигарет більше 35 штук в день. Слід зазначити, що у всіх випадках 3 стадії тютюнової залежності пацієнти незалежно від статі і віку припиняли куріння вночі і натщесерце.
-ендорфін в ЦНС і кровотік для зменшення абстинентного синдрому (додаток). Для цих хворих були характерні наступні параметри: стаж куріння більш ніж 30-35 років, кількість викурених сигарет більше 35 штук в день. Слід зазначити, що у всіх випадках 3 стадії тютюнової залежності пацієнти незалежно від статі і віку припиняли куріння вночі і натщесерце.
У разі 1 стадії тютюнової залежності з 6 пацієнтів тільки 4 пацієнтів припинили курити. Чи не змогли відмовитися від куріння 2 жінки, так як для цієї групи було характерно викурювання сигарет в кількості до 3-5 штук в день.
З 20 пацієнтів з 2 стадією тютюнової залежності 4 людини зізналися, що під час лікування вони забували приймати в зазначені терміни грандаксин, а в щоденниках відбивали його прийом. Відповідно ці пацієнти були виключені із загальної вибірки.
Через 30 днів після останнього дня лікування всі пацієнти були запрошені в амбулаторному порядку для огляду і проведення функціональних досліджень. Пацієнти, які в силу об'єктивних причин не змогли з'явитися на прийом, були опитані по телефону (6 чоловік з 31).
Функціональні дослідження показали, що за місяць у 70% добровольців було достовірне збільшення ЖЕЛ (життєва ємність легенів) в середньому на 150 ± 20 мл, зменшення цифр артеріального тиску - систолічного на 30 ± 8 мм рт.ст., діастолічного на 15 ± 8, 6 мм рт.ст. У вазі додало 2 людини, що було пов'язано з їх перебуванням на санаторно-курортному лікуванні. Математична обробка результатів проводилася за допомогою програми "Біостатистика. Версія 4.03" і оцінювалася за критерієм Стьюдента.
Скарг на порушення з боку шлунково-кишкового тракту у виразкових хворих - 26 осіб не було пред'явлено. Були проаналізовані дані щоденників пацієнтів з вегето-судинними порушеннями (31 чоловік) і контрольної групи (12 осіб), відзначалося достовірне поліпшення якості сну, зменшення головного болю і запаморочення, покращився емоційний фон, який виражався у вигляді впевненості у власних силах і радістю припинення куріння. З'явився новий етап в житті, пов'язаний з економічними і позитивними соціальними проявами.
Результати проведеного дослідження показали наступні переваги застосування комбінованого способу лікування тютюнової залежності перед наявними методами лікування: можливість лікування вдома, відсутність тиску з боку медперсоналу, право вибору часу і місця лікування, готовність до повторного курсу лікування, значна економія фінансів, пов'язана з відсутністю мотивації придбання сигарет і зменшення витрат на лікарські препарати, які необхідно було приймати в період куріння сигарет.
Особливістю застосування грандаксина в лікуванні тютюнової залежності є добра переносимість його пацієнтами, несподіване використання препарату в рішенні проблем, пов'язаних з тютюновою залежністю, практично повна відсутність побічних ефектів і повна відсутність звикання до препарату, можливість призначення препарату лікарем первинної ланки всім бажаючим лікуватися від тютюнової залежності.
ДЖЕРЕЛА ІНФОРМАЦІЇ
1. Смирнов В.К. Тютюнова залежність і куріння тютюну. - М., 1993, с.32.
2. Смирнов В.К. Клініка і терапія тютюнової залежності. - М., 2000., с.95.
3. Вейн А.М., Поморцева І.В. Особливості фармакології грандаксина. Досвід застосування грандаксина при розладах психічної адаптації і перманентних вегетативних порушеннях .// Матеріали науково-практичної конференції. - СПб, 1999..
4. Смирнов В.К., Мельникова Т.С., Лікування психосоматичної і диссоциированной форм тютюнової залежності методом краніальної електростимуляції. Методичні рекомендації, 1986.
5. Мельникова Т.С, Буренко Б.Н. і Смирнов В.К., авторське свідоцтво СРСР №1242186, кл. А 61 Н 1/36, 07.07.86.
6. Сапронов Н.С. Фармакологія гіпофізарно-надниркової системи. - СПб., 1998, с.232.
7. Aguilamansilla N; Little BB; Але RH; Bamea A Differential potencies of cocaine and its metabolites, cocaethylene and benzoylecgonine, in suppressing the functional expression of somatostatin and neuropeptide Y producing neurons in cultures of fetal cortical cells. Univ. Texas, SW Med Ctr, Dept Obstet Gynecol, Dallas, TX 75235 USA. Biochem Pharmacol. 1997; 54 (4): 491-500.
ФОРМУЛА ВИНАХОДУ
1. Спосіб комбінованого лікування тютюнопаління, що включає вплив одночасної комбінації постійного і змінного струму на гіпоталамо-гіпофізарну надпочечниковую систему організму, який відрізняється тим, що вплив здійснюють методом мезодіенцефальной модуляції з частотою впливає струму 76 Гц, з девіацією частоти 20 Гц, періодом зміни частоти 80 з і кроком зміни частоти 1,0 Гц, при співвідношенні величини постійного і змінного струму 2: 3, яку обирають при заданій величині постійного струму в діапазоні 0,07-4,7 мА, при цьому пацієнт отримує грандаксин в дозі 150-300 мг щодня .
2. Спосіб за п.1, що відрізняється тим, що форма змінного струму в залежності від клінічної форми захворювання, зумовленого палінням, може бути прямокутної - при хворобах органів системи кровообігу, трапецеидальной - при хворобах нервової системи, складної, що складається з 4 імпульсів тривалістю 200 мкс з періодом проходження 1 мс - при хворобах органів шлунково-кишкового тракту.
Версія для друку
Дата публікації 06.01.2007гг




Коментарі
Коментуючи, пам'ятайте про те, що зміст і тон Вашого повідомлення можуть зачіпати почуття реальних людей, проявляйте повагу та толерантність до своїх співрозмовників навіть у тому випадку, якщо Ви не поділяєте їхню думку, Ваша поведінка за умов свободи висловлювань та анонімності, наданих інтернетом, змінює не тільки віртуальний, але й реальний світ. Всі коменти приховані з індексу, спам контролюється.