| початок розділу
Виробничі, аматорські радіоаматорські Авіамодельний, ракетомодельного Корисні, цікаві |
хитрощі майстру
електроніка фізика технології винаходи |
таємниці космосу
таємниці Землі таємниці Океану хитрощі Карта розділу |
|
| Використання матеріалів сайту дозволяється за умови посилання (для сайтів - гіперпосилання) | |||
Навігація: => |
На головну / Каталог патентів / В розділ каталогу / Назад / |
|
ВИНАХІД
Патент Російської Федерації RU2019186
![]()
СПОСІБ ингибицией ВІЛ-інфекції
Ім'я винахідника: Биковський А.Ф .; Міллер Г.Г .; Покідишева Л.М .; Титова І.В .; Артюков О.О .; Попов А.М .; Прозоровський С.В .; Лоенко Ю.М .; Хесс Джозеф [US]; Еляков Г.Б .; Стонік В.А .; Ісаков В.В.
Ім'я патентовласника: Науково-дослідний інститут епідеміології та мікробіології ім.Н.Ф.Гамалеі; Тихоокеанський інститут біоорганічної хімії
Адреса для листування:
Дата початку дії патенту: 1991.02.28
Використання: в медицині, а саме для профілактики і лікування СНІДу та СНІД-асоційованих захворювань. Сутність: в способі використовують низькомолекулярний сульфатованих полісахарид з мовляв. в. менше 20000 Дальтон з фукоза, Сульфатовані по 4-му положенню, залишки якої пов'язані Глікозидний зв'язками, і корелюють з уроновая кислотами при співвідношенні 1: 4 (SO 3 -FUC, UA = COOH), при цьому вихідний продукт отримують на водорості ламінарія японська. Позитивний ефект: сульфатованих полісахарид низького мовляв. в. не проявляє будь-якої токсичності для клітин ін вітро в дозах понад 5000 мкг / мг.
ОПИС ВИНАХОДИ
Винахід відноситься до медицини, а саме для профілактики і лікування СНІДу та СНІД-асоційованих захворювань.
Відомий спосіб ингибиции ВІЛ-інфекції за допомогою фукоїдан.
Недоліком відомого способу є те, що фукоїдан володіє токсичністю.
Метою винаходу є зниження токсичності.
Дана мета досягається використанням низькомолекулярного Сульфатовані полісахариду (НСП) з мол.в. близько 15000 Дальтон, що містить фукоза, Сульфатовані по 4-му положенню, залишки якої пов'язані Глікозидний зв'язками і корелюють з уроновая кислотами при співвідношенні 1: 4 (SO 3 -FUC; UA-COOH), при цьому вихідний продукт отримують з водорості ламінарія японська ( Laminaria japonica).
НСП має наступні характеристики.
Фізична характеристика полісахариду. Матеріал і методи.
Хроматографічний аналіз був проведений на скляній колонці з гідрофобним сорбентом Поліхром-1 і з сефакрілом S-300 (фармація, Швеція) з використанням детектора 1КВ UV-VIS (при 254 нм з 2 мл препаративної проточною клітини). Карбогідрати визначали фенольно-сірчанокислим методом.
Для аналізу моносахаридів використовували рідинну газову хроматографію на хроматографе Світло-2 зі скляною колонкою 2,5 х 0,4 см (3% OV-225 на хроматрона N-HMDS) при 150-230 о, 5 об / хв.
Зразки для аналізу готували гідролізом полисахаридного препарату при 90 о С протягом 2 год з 2N HCl з наступним отриманням перацетата альгітола звичайним способом.
Спектр ядерного магнітного резонансу (Н і 13 С ЯМР) визначали на спектрометрі Bryker WM-250. Хімічні зсуви реєстрували в ppm від тетраметілксілана.
Результати.
НСП (МВ близько 15000 Дальтон), білий аморфний порошок; [ ![]() ] 27,825 = 13 C ЯМР (Д 20); 102,4; 101,2; 100,7; 99,1 ppm (C-1) 13 C ЯМР (Д 2 О); альгінат: 102,4; 101,2; 100,7 (С-1) 71,2; 71,8; 66,0 (С-2) 72,6; 72,8; 70,5 (С-3) 79,2; 801,1 (С-4) 772; 682 (С-5) 176,1; 175,8; 175,6 (С-6) фукоїдан: 99,1 (С-1) 74,9 (С-2) 67,9 (С-3) 81,3 (С-4) 67,9 (С-5) 17,2; 16,6 (С-6).
] 27,825 = 13 C ЯМР (Д 20); 102,4; 101,2; 100,7; 99,1 ppm (C-1) 13 C ЯМР (Д 2 О); альгінат: 102,4; 101,2; 100,7 (С-1) 71,2; 71,8; 66,0 (С-2) 72,6; 72,8; 70,5 (С-3) 79,2; 801,1 (С-4) 772; 682 (С-5) 176,1; 175,8; 175,6 (С-6) фукоїдан: 99,1 (С-1) 74,9 (С-2) 67,9 (С-3) 81,3 (С-4) 67,9 (С-5) 17,2; 16,6 (С-6).
13 С - ЯМР спектр визначали на спектрометрі WM-250 (Bryker).
Таким чином, показано, що полисахаридная фракція є низькомолекулярним компонентом з фукоза, Сульфатовані по 4-му положенню і її залишки пов'язані ![]() -1,2-Глікозидний зв'язками і корелюють з уроновая кислотами (маннуровой і гулуроновой) в співвідношенні 1: 4 (SO3-FUC: UA-COOH).
-1,2-Глікозидний зв'язками і корелюють з уроновая кислотами (маннуровой і гулуроновой) в співвідношенні 1: 4 (SO3-FUC: UA-COOH).
Біологічна характеристика полісахариду.
П р и м і р 1. Інгібуюча активність НСП проти адсорбції ВІЛ-1 і цитопатичної дії вірусу визначалася на клітинах МТ4 наступним чином:
a) Прямий вируснейтрализующие ефект
1 мл суспензії ВІЛ-1, отриманої після високошвидкісного центрифугування віруссодержащей культуральної рідини з клітин Н9 / ШВ або НТН1У 27 і 1 мл розчину НСП у відповідних концентраціях (0,1 до 100 мкг / мл) поміщали в пробірки і залишали для контакту на 2 ч при 37 о С або кімнатній температурі. Після цього рівні кількості клітин МТ4 предобработанних полібреном були додані в кожну пробірку для адсорбції вірусу з множинністю інфекції (МІ), що дорівнює 100, і залишали для контакту при 37 о С на 1-1,5 ч.
Після контакту клітини осаджували низькошвидкісним центрифугуванням протягом 10 хв, супернатант видаляли, клітини ресуспендіровалі в середовищі РРМ1 1640 з 10% фетальної телячої сироватки до кінцевої концентрації 2 х 10 5 кл / мл. Клітинну суспензію в кількості 1 мл розподіляли в 24-ямкові плато і культивували при 37 о С і 5% СО2 протягом 7 днів.
б) Інгібуючий ефект НСП на адсорбцію ВІЛ-1 на клітинах МТ4.
За 2х10 5 кл / мл МТ4 розподіляли в кожну лунку 24-ямковий плато і після короткого періоду осідання клітин на дні лунок вносили відповідні концентрації НСП і преінкубіровалі при 37 о С протягом 1 год, після чого вносили вірусну суспензію з МІ-100 і культивували клітини при тих же умовах 7 діб. Відсоток клітин, експресуватися і неекспрессіровавшіх вірусний антиген на поверхневій мембрані обчислювали як середнє арифметичне трьох повторностей від кожних 100 клітин в методі непрямої імунофлуоресценції.
Співвідношення Х адсорбції-ингибиции вірусу, залежне від концентрації НСП визначали за такою формулою,%: ![]() де a - антиген позитивних клітин в препаратах, оброблених НСП,%;
де a - антиген позитивних клітин в препаратах, оброблених НСП,%;
b - антиген позитивних клітин в необроблених препаратах,%
100 - антиген позитивних клітин в контрольних препаратах (див. Табл. 1 і 2).
Антикоагуляційний ефект НСП був більш ніж в 10 разів нижче, ніж у гепарину. Якщо 50% значення для анти-ВІЛ активності на клітинах МТ4 (див. Табл. 1 і 2) перевести з мкг / мл в од / мл, отримаємо наступні значення, од / мл: НСП 6,7х10 -3; фукоїдан 3,6х10 -3; гепарин 1 х 10-3.
Таким чином, НСП володіє анти-ВІЛ активність при концентраціях більше ніж в 100 разів низьких, ніж його антикоагуляційної активність.
Визначення ін віво і ін вітро гострої токсичності полисахаридной фракції НСП.
Визначення гострої токсичності ін віво проводили на білих мишах (по 10 тварин в кожній групі), 4-5 тижневого віку, масою 21-24 м НСП, розведений в фізіологічному розчині в відповідних концентраціях, вводили тваринам трьома різними шляхами: внутрішньовенно, внутрішньоперитонеально, перорально. Провідні симптоми, загибель і масу тіла досліджували у кожної тварини протягом 7-денного періоду спостереження, після чого кожна тварина забивали і піддавали анатомічному дослідженню внутрішні органи. Як показано в табл. 3, ні в однієї тварини, яка отримувала препарат одним із зазначених способів, не було виявлено ніяких симптомів гострої токсичності або будь-яких порушень морфології внутрішніх органів (див. Табл. 4).
Цитотоксичність НСП ін вітро на клітинах МТ4 і Н9 проявлялась навіть при концентраціях препарату вище 5000 мкг / мл в порівнянні з прототипна фукоіданом, для якого 50% цитотоксическая доза, що визначається за виживання клітин MT4, дорівнює 1060 ± 210 мкг / мл або з азидотимидином ( Сигма), який токсичний для клітин при концентраціях понад 1000 мкг / мл.
Таким чином, НСП може бути використаний як у вигляді самостійної формули, так і в якості складового компонента фармацевтичної композиції або в комбінації з іншими відомими препаратами, такими як АЗТ.
Інгібуючий ефект НСП на назад транскріптазная активність ін вітро визначали з використанням вірусу пташиного міелобластоза (АМВ) в якості джерела ензиму (надано НДІ молекулярної біології і генетики АН СРСР, Київ). Тестування проводили за відомим методом. 2 мг НСП розчиняли в 1 мл стерильної дистильованої води і доводили до відповідних концентрацій. 20 мл обсяг реакційної суміші складався з:
50 мМ Тріс-HCl, pH 8,2; 5 ![]() М MgCl 2; 1
М MgCl 2; 1 ![]() g олиго (d АТР) РНК, рН 8,2 в якості матриці, 20
g олиго (d АТР) РНК, рН 8,2 в якості матриці, 20 ![]() М dАТР, dСТР, dТТР і 0,5
М dАТР, dСТР, dТТР і 0,5 ![]() Ki 3 H-dСТР; 60
Ki 3 H-dСТР; 60 ![]() М KCl, 1
М KCl, 1 ![]() М
М ![]() -меркаптоетанола і поміщали в 1,5 мл пробірки Еппендорф, які поміщали у водяну баню при 37 о С на 5 хв. Після цього 20 мкл раніше приготовленого розчину НСП відповідних концентрацій додавали в реакційну суміш разом з 1 мкл зворотної транскриптази АМВ і залишали для взаємодії при 37 о С на 1 ч. Після цього реакційну суміш переносили на мембранні фільтри ДЕ-81, промивали 5 разів з 5 -хвилинний перервою при струшуванні, висушували і поміщали в скляні контейнери, що містять по 10 мл рідкого сцинтиляційного коктейлю. Радіоактивність (с.р.м.) кожного фільтра підраховували за 1 хв в сцінцілляціонном лічильнику. Рівень ингибиции назад транскриптазної активності (ІТА) підраховували за формулою
-меркаптоетанола і поміщали в 1,5 мл пробірки Еппендорф, які поміщали у водяну баню при 37 о С на 5 хв. Після цього 20 мкл раніше приготовленого розчину НСП відповідних концентрацій додавали в реакційну суміш разом з 1 мкл зворотної транскриптази АМВ і залишали для взаємодії при 37 о С на 1 ч. Після цього реакційну суміш переносили на мембранні фільтри ДЕ-81, промивали 5 разів з 5 -хвилинний перервою при струшуванні, висушували і поміщали в скляні контейнери, що містять по 10 мл рідкого сцинтиляційного коктейлю. Радіоактивність (с.р.м.) кожного фільтра підраховували за 1 хв в сцінцілляціонном лічильнику. Рівень ингибиции назад транскриптазної активності (ІТА) підраховували за формулою
ІТА = ![]() x 100,%, де С о - контрольна радіоактивність зразка без НСП;
x 100,%, де С о - контрольна радіоактивність зразка без НСП;
C s - радіоактивність зразка після преінкубаціі з НСП.
Рівень ингибиции ВІД активності показаний на кресленні.
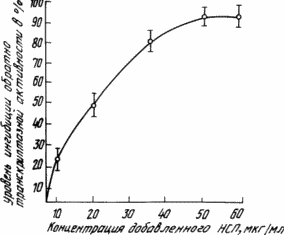
Таким чином, сульфатованих полісахарид низького мол.в. не проявляє будь-якої токсичності для клітин ін вітро в дозах понад 5000 мкг / мл і лабораторних тварин ін віво і може бути отриманий за допомогою дешевої безвідходної технології шляхом обробки морської водорості (Laminaria japonica).
ФОРМУЛА ВИНАХОДУ
СПОСІБ ингибицией ВІЛ-інфекції шляхом застосування Сульфатовані полісахариду, який відрізняється тим, що, з метою зниження токсичності, використовують низькомолекулярний сульфатованих полісахарид з мол.м. менше 20000 Дальтон, з фукоза, Сульфатовані по 4-му положенню, залишки якої пов'язані Глікозидний зв'язками і корелюють з уронові кислоти при співвідношенні 1: 4 (SO 3 - FUC; UA - COOH), при цьому вихідний продукт отримують з водорості Ламінарія японська ( Laminaria japonica).
Версія для друку
Дата публікації 06.01.2007гг




Коментарі
Коментуючи, пам'ятайте про те, що зміст і тон Вашого повідомлення можуть зачіпати почуття реальних людей, проявляйте повагу та толерантність до своїх співрозмовників навіть у тому випадку, якщо Ви не поділяєте їхню думку, Ваша поведінка за умов свободи висловлювань та анонімності, наданих інтернетом, змінює не тільки віртуальний, але й реальний світ. Всі коменти приховані з індексу, спам контролюється.