| початок розділу
Виробничі, аматорські радіоаматорські Авіамодельний, ракетомодельного Корисні, цікаві |
хитрощі майстру
електроніка фізика технології винаходи |
таємниці космосу
таємниці Землі таємниці Океану хитрощі Карта розділу |
|
| Використання матеріалів сайту дозволяється за умови посилання (для сайтів - гіперпосилання) | |||
Навігація: => |
На головну / Каталог патентів / В розділ каталогу / Назад / |
|
ВИНАХІД
Патент Російської Федерації RU2036235
![]()
СПОСІБ інактивації вірусів В КРОВІ ТА ЇЇ КОМПОНЕНТИ
Ім'я винахідника: Харальд Мор [DE]; Бернд Ламбрехт [DE]
Ім'я патентовласника: Блутшпендедінст дер Ландесфербенде Дес Дойче Ротен Кройцес Нідерзаксен, Ольденбург унд Бремен ГГмбХ (DE)
Адреса для листування:
Дата початку дії патенту: 1992.03.1
Використання: вірусологія, біотехнологія.
Суть винаходу: проводять інактивацію вірусів в крові і її компонентах шляхом змішування оброблюваного розчину або суспензії з Фенотіазинові барвником і подальшого опромінення світлом, при цьому фенотіазинового барвник використовують в концентрації 0,1 - 10 мкмоль, причому опромінення здійснюють безпосередньо в прозорих ємностях, службовців для взяття і зберігання крові.
ОПИС ВИНАХОДИ
Винахід стосується боротьби з вірусами, зокрема інактивації вірусів у крові та її компонентах.
Відомий спосіб інактивації вірусів, при якому віруси у вигляді рідини змішують в колбі з Фенотіазинові барвником з подальшим опроміненням світлом (див. В. Снайпес і ін. 1979 р Photochem. І Photobiol. 29, стор. 785-790). При перенесенні відомого способу на інактивацію вірусів в крові і компонентах крові було встановлено, що при цьому мала місце інактивація не тільки вірусів, але і білків плазми крові, як, наприклад, факторів згортання.
Мета винаходу розробити простий спосіб інактивації вірусів у крові та її компонентах, при якому різного роду віруси умерщвляются без істотного функціонального впливу на білки плазми крові.
Поставлена задача вирішується в способі інактивації вірусів у крові та її компонентах шляхом змішування оброблюваного розчину або суспензії Фенотіазинові барвником і подальшого опромінення світлом за рахунок того, що фенотіазинового барвник використовують в концентрації 0,1-10 мкмоль, причому опромінення здійснюють безпосередньо в прозорих ємностях, службовців для взяття і зберігання крові. Опромінення здійснюють денним світлом достатньої інтенсивності або монохроматним світлом, переважно джерела холодного світла, що має довжину хвиль в області максимуму абсорбції відповідного барвника. Крім того, при інактивації вірусів у плазмі крові або в розчинах білків плазми крові необхідно дотримуватися таких умов. Робоча температура повинна становити 0--37 ° С, але по можливості 4-20 о С. Процес інактивації триває, зокрема, від 5 хв до 5 год, переважно від 10 хв до 3 год. Величина рН оброблюваної середовища повинна складати 5 9, переважно 6-8.
Було встановлено, що не має оболонку вірус, як, наприклад, аденовірус, який не можна інактивувати в плазмі в фізіологічних умовах, можна фотосенсібілізірованних шляхом прийомів заморожування і подальшого відтавання, після чого можна успішно проводити інактивацію. При цьому інактивацію можна встановити незалежно від послідовності прийомів заморожування і подальшого відтавання і додавання фарбника. Під заморожуванням розуміється процес глибокого заморожування розчиненими газами в якості холодоагенту при температурі приблизно від -20 ° С до 80 о К. Як правило, заморожування здійснюють при температурі -30 о С.
Інактивацію вірусів можна проводити безпосередньо в мішках, призначених для зберігання крові або плазми крові, хоча ці мішки мають лише обмеженою светопропускаемостью. В такому випадку пропонований спосіб зводиться лише до додавання фарбника з подальшим опроміненням мішка разом з його вмістом. Потім відповідний продукт може далі оброблятися.
Таким чином, пропонований спосіб можна здійснювати простими технічними засобами і тому він може інтегруватися в технологічний процес обробки донорської крові у відповідних сховищах. Незначна кількість доданого барвника може залишатися в далі оброблюваної рідини. У разі необхідності його можна видалити за допомогою адсорбера. Під поняттям крові і її компонентів розуміються: цільна кров, концентрати еритроцитів, концентрати тромбоцитів, плазма крові, сироватка, кріоосадок, концентрати факторів згортання, інгібітори, фибронектин, альбумін.
У пропонованому способі використовують фенотіазини наступної структурної формули
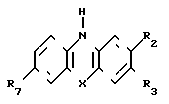
У табл. 1 наведені значення Х, R 2, R 3, R 7.
приклад 1
Фотоінактіваціі піддають везикулярно-стоматітний вірус в плазмі крові людини в присутності метиленового синього. При цьому приблизно 5 · 10 7 пятнообразующіх одиниць на мл вірусу суспендують в плазмі крові людини і змішують з метиленовим синім, застосовуваним в різних концентраціях. Контрольні проби не містять барвника. Обсяг проб становить 0,5 мл. Одну контрольну пробу і частина містять метиленовийсиній проб опромінюють видимим світлом при кімнатній температурі протягом 4 ч. Решта проби зберігають протягом того ж періоду часу. Як джерело світла служить діапроектор, оснащений галогенною лампою потужністю 150 Вт. Відстань між об'єктивом діапроектор, т. Е. Отвором випуску світла, і пробами у всіх дослідах становить 30 см (за винятком випадку інактивації вірусів у мішках для зберігання крові). Після опромінення у всіх пробах визначають титр вірусів за допомогою аналізу плям. Як індикатор сушать клітини ВНК (АТСС N ССС10). Результати дослідів зведені в табл. 2.

Дані табл. 2 свідчать про те, що, починаючи з концентрації метиленового синього, рівній 0,5 мкмоль, інфекційний титр вірусу зменшується більш ніж на 6 десяткових ступенів.
приклад 2
Даний досвід підтверджує інактивацію вірусу при низьких концентраціях барвника.
Аліквоти плазми крові об'ємом 500 мкл, що містять везикулярно-стоматітний вірус і різну кількість метиленовогосинього, піддають опроміненню за допомогою розміщеного на відстані 30 см діапроектор в холодильній камері. Проби А-Е опромінюють, а проба Ж залишається неопромінених.
Результати досвіду зведені в табл. 3. Вони показують, що в даних умовах зазначений вірус інактивується більш ніж на 4 десяткові ступеня. Для цього необхідна концентрація метиленовогосинього, рівна 0,5 мкмоль. Одна інкубація протягом ночі при 4 ° С ймовірно призводить до зменшення титру вірусу на 1-2 десяткові ступеня, що може бути поясненням для відносно низького вихідного титру. Але ця обставина докладно не досліджувався.
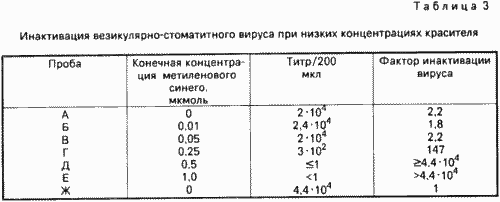
Порівняння результатів інактивації облученной проби А з пробою Ж (тільки зберігання в темряві) показує, що один світло очевидно не робить великого впливу на інфекційність вірусу.
приклад 3
Досліджується залежність фотоінактіваціі вірусів в присутності фенотіазинових барвників від тривалості опромінення. При цьому 10 6 пятнообразующіх одиниць на мл суспендують в плазмі крові і проби опромінюють описаним в попередніх прикладах чином при 22 о С протягом зазначеного в табл. 4 часу. За даними табл. 4 видно, що в даних умовах одночасове опромінення досить для зменшення інфекційного титру везикулярно-стоматітного вірусу більш ніж на 6 десяткові ступеня.

приклад 4
Повторюють приклад 3 з тією різницею, що інактивацію проводять в присутності 1 мкмоль толуїдинового синього. Результати досвіду, зведені в табл. 5, свідчать про те, що везикулярно-стоматітний вірус може ефективно инактивироваться і в присутності толуїдинового синього.

У присутності фенотіазинових барвників можна і инактивировать вірус бульбашкового лишаю HSV, а й вірус СНІДу HIV-1, про що свідчать результати прикладів 5 і 6.
приклад 5
Інактивацію вірусу НSV здійснюють в присутності 1 мкмоль метиленовогосинього. У табл. 6 зведені дані щодо кінетики фотоінактіваціі вірусу HSV.

приклад 6
Інактивацію вірусу HIV-1 проводять в присутності 1 мкм метиленовогосинього. При цьому титр вірусу становить 6 х 10 2 пятнообразующіх одиниць / мл і як індикатор застосовують клітини МТ4 (інфікована HTLV-1 Т-лімфобластоідних клітинна лінія людини). Результати досвіду, зведені в табл. 7, свідчать про те, що вірус HIV-1, є дуже чутливим до фотоінактіваціі, так як вже протягом перших 10 хв титр вірусу зменшується більш ніж в 600 разів.

приклад 7
Інактивація не мають оболонку вірусів в звичайних фізіологічних умовах у присутності 80% плазми не увінчалася успіхом. При цьому як приклад вірусу без оболонки застосовувався аденовірус, який попередньо інкубують протягом зазначеного в табл. 8 часу при 4 о С в темряві в присутності 1 мкмоль метиленовогосинього. Потім здійснюють 30-хвилинне опромінення за допомогою галогенової лампи освітленістю 150 000 люкс. При цьому інфекційність аденовірусу залишається незмінною. Результати досвіду зведені в табл. 8.

При застосуванні толуїдинового синього в тих же експериментальних умовах і не спостерігається зменшення титру вірусу.
Для досягнення інактивації аденовірусу в процес включають прийоми заморожування і відтавання (далі: "за / від"), при цьому заморожування здійснюють до -30 о С. Послідовність прийомів за / від і момент додавання фарбника (1 мкмоль метиленовогосинього) грають лише другорядну роль . Опромінення проб здійснюють за допомогою галогенною лампи освітленістю 120 000 люкс. Результати досвіду зведені в табл. 9.

приклад 8
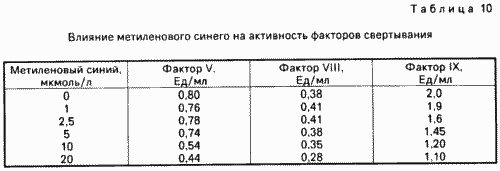
Даний досвід спрямований на дослідження впливу барвника в різних концентраціях на активність факторів згортання. При цьому по 2 мл аліквоти плазми крові людини змішують з різними кількостями метиленовогосинього. Безпосередньо після додавання фарбника вимірюють активність факторів згортання V, VIII і IX. Як видно за даними табл. 10, всі фактори згортання ингибируются в залежності від концентрації барвника, т. Е. Інгібація факторів VIII і V починається з концентрації приблизно 10 мкм, а фактор IX вже відзначено зниження при наявності барвника в концентрації приблизно 2,5 мкм. Таким чином, метиленовийсиній в більш високих концентраціях впливає безпосередньо на білки без впливу світла.
Результати досвіду зведені в табл. 10.
приклад 9
На активність факторів згортання впливає не тільки концентрація барвника, а й час опромінення. Ця залежність досліджується в даному прикладі. Для цього аліквоти (2 мл) плазми крові людини змішують з різними кількостями метиленовогосинього і піддають опроміненню описаним в прикладі 1 чином протягом 1-4 ч. Контрольні проби не піддають фотообробки. Дані табл. 11 показують, що активність трьох факторів згортання V, VIII і IX відзначено зниження в залежності від часу опромінення і концентрації барвника. Зокрема дані за такими чинниками згортання VIII і IX свідчать про те, що більш висока концентрація метиленовогосинього і опромінення світлом з тривалістю від 2 ч призводить, очевидно, до посилення тромболітичної ефекту.
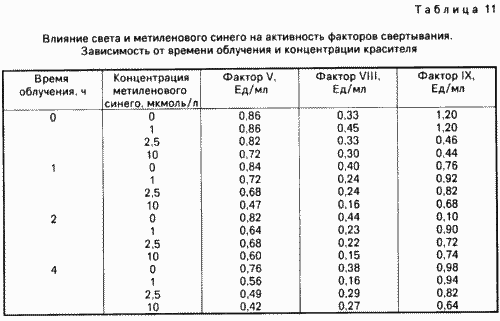
приклад 10
Згідно винаходу фотоінактівацію вірусів здійснюють безпосередньо в прозорих ємностях, службовців для взяття і зберігання крові або її компонентів, після попереднього додавання фарбника в необхідній кількості. Таким простим шляхом можна в будь-який момент обробити кров і її компоненти окремих донорів.
В даному прикладі розморожують три проби свіжої плазми крові людини, до яких в своїх ємностях додають 1,5 · 10 6 пятнообразующіх одиницю везикулярно-стоматітного вірусу. До двох проб додають метиленовийсиній в концентрації 1 і 10 мкмоль відповідно. З не містить метиленовийсиній плазми беруть пробу, яку в якості позитивного контролю зберігають в темряві при 4 о С. Потім все ємності затискають між двома плексігласнимі пластинками з тим, щоб забезпечити рівномірну товщину шару приблизно 2,5 см. Ємності опромінюють за допомогою діапроектор, розміщеного на відстані 90 см. Через 4 год беруть проби, які для визначення титру вірусу подають на клітини FL. Результати досвіду зведені в табл. 12.

Дані табл. 12 свідчать про те, що вже концентрація 1 мкмоль метиленовогосинього достатня для зниження інфекційного титру везикулярно-стоматітного вірусу більше ніж на три десяткові ступеня. Навіть при відсутності барвника опромінення проводить до зниження титру вірусу, однак лише приблизно на 50%
При концентраціях до 1 мкмоль застосовуються для інактивації вірусів фенотіазинові барвники можуть залишатися в крові або її компонентів без будь-яких побічних дій. Але вони можуть і віддалятися за допомогою діалізу, гель-фільтрації або адсорбції. Найбільший інтерес представляє адсорбція, так як вона пов'язана з найменшими витратами часу і технології і крім того відповідні розчини білків не потребують розведенні. Було встановлено, що метиленовийсиній і інші фенотіазинові барвники зв'язуються з різними, наявними у продажу розділовими гелями, в тому числі і з такими гелями, які не володіють здатністю до зв'язування білків або ж мають лише слаборозвиненою здатністю до їх зв'язування. Таким чином, такі адсорбенти особливо придатні для подальшого видалення фотоокіслітеля. З числа досліджених адсорбентів для відділення метиленовогосинього і інших фенотіазинових барвників можна з успіхом застосовувати агенти, наведені в табл. 13.

У більшості випадків для повної екстракції з розчину білків плазми метиленовогосинього в концентраціях 10 мкмоль досить 2 г відповідного адсорбенту. Найбільш придатними виявилися два типи адсорбентів.
1. Силікагель з діаметром пір 40-100 ![]() , Які не дозволяють білкам плазми проникати в матрицю. Але молекули низькомолекулярних барвників надійно зв'язуються в силу іонних, електростатичних і гідрофобних взаємодій. Прикладами таких загальнодоступних адсорбентів є Матрекс Силіка Гель інофірми Аміконі, м Віттен, ФРН, дальтозіль інофірми Серва, м Хейдельберг, ФРН, і кізельгель інофірми Мерк, м Дармштадт, ФРН.
, Які не дозволяють білкам плазми проникати в матрицю. Але молекули низькомолекулярних барвників надійно зв'язуються в силу іонних, електростатичних і гідрофобних взаємодій. Прикладами таких загальнодоступних адсорбентів є Матрекс Силіка Гель інофірми Аміконі, м Віттен, ФРН, дальтозіль інофірми Серва, м Хейдельберг, ФРН, і кізельгель інофірми Мерк, м Дармштадт, ФРН.
2. Гелі на основі полістиролу і дивинилбензола або полімерів складних ефірів акрилової кислоти. Прикладами наявних у продажу гелів цих типів є амберліта, що випускаються, наприклад, инофирмой Рем унд Хаас, м Франкфурт на Майні, ФРН, і біо бідс інофірми Біо Радий, м Мюнхен, ФРН. Вони в основному служать для видалення неполярних або поверхнево-активних речовин, наприклад миючих агентів, з водних розчинів. Вони є неполярними або ж лише слабополярная.
приклад 11
Свіжу плазму крові змішують з 10 мкмоль метиленовогосинього (м. С.). Аліквоти об'ємом 5 мл змішують з різними кількостями дальтозіль (діаметром пір 75 ![]() ) І біо бідс СМ 16 (діаметром пір 144
) І біо бідс СМ 16 (діаметром пір 144 ![]() ) Відповідно, після чого перемішують протягом 30 хв. Потім гелю дають відстоятися. У плазмі крові визначають змісту фактора VIII і фактора V, екстинкцію при 660 нм, а й вміст білків у деяких проб.
) Відповідно, після чого перемішують протягом 30 хв. Потім гелю дають відстоятися. У плазмі крові визначають змісту фактора VIII і фактора V, екстинкцію при 660 нм, а й вміст білків у деяких проб.
Результати досвіду зведені в табл. 14.
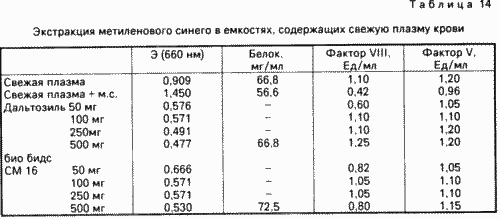
За даними екстинкції видно, що поряд з барвником з плазми очевидно екстрагуються ще інші речовини, які, однак, не є білки плазми. Дані по екстинкції плазми, обробленої 100-250 мг адсорбенту на 5 мл, тобто 2-5 мас. / На обсяг, чи відрізняються від тих даних екстинкції проб, які екстрагували 10 мас. адсорбенту / обсяг проби. Отже, при концентрації метиленовогосинього 10 мкм досить застосування адсорбенту в кількості 2-5 мас. / Обсяг проби з тим, щоб в разі періодичного здійснення процесу повністю видаляти барвник з плазми. При менших концентраціях барвника потрібно відповідно менша витрата адсорбенту.
приклад 12
В даному прикладі замість плазми крові застосовують 5% -ний розчин альбуміну сироватки людини (далі: АСЧ). В даному досвіді концентрація метиленовогосинього становить 10 мкмоль. Аліквоти об'ємом 5 мл екстрагують 100 мг (2 мас. Обсяг) наступних адсорбентів: дальтозіль (діаметром пір 75 ![]() ), Силікагель (діаметром пір 40
), Силікагель (діаметром пір 40 ![]() ) І біо бідс СМ 16 (діаметром пір 144
) І біо бідс СМ 16 (діаметром пір 144 ![]() ).
).
Результати досвіду показані на кресленні. По ньому видно, що у всіх випадках екстинкція при 660 нм падає, тобто зазначений час досить для періодичного видалення фотоокіслітеля з розчину протеїну. За кресленням і видно, що в даному випадку адсорбенти біо бідс СМ 16 і силікагель з діаметром пір 40 ![]() є більш ефективними, ніж дальтозіл з діаметром пір 75
є більш ефективними, ніж дальтозіл з діаметром пір 75 ![]() .
.
приклад 13
В даному прикладі досліджують можливість адсорбционного видалення метиленовогосинього з розчину білків плазми крові шляхом колонкової хроматографії. В основу такого методу покладено ідею про те, що після інактивації вірусів за допомогою барвника і опромінення розчин білків плазми можна пропускати через колонку з адсорбентом і звідти подавати в подальшу ємність, що служить для зберігання обробленого розчину. При цьому колонку можна розміщувати між обома ємностями. Таким чином, можливе попереднє виготовлення вузла, що складається з двох ємностей з розміщеної між ними адсорбційної колонкою. Тим самим можна створити замкнуту систему, яка набагато знижує ризик зараження минулого інактивацію вірусу препарату білків плазми, в тому числі і препаратів від окремих донорів.
Даний досвід здійснюють наступним чином.
250 мл. 5% -го розчину альбуміну пропускають з різною швидкістю через колонку, що містить 5 мл силікагелю з діаметром пір 40 ![]() . Фракції об'ємом 10 мл збирають і піддають екстинкції при 660 нм. За даними табл. 15 видно, що весь розчин альбуміну можна пропускати зі швидкістю 5 і 7,5 мл / хв відповідно через колонку без того, щоб в одержуваних фракціях можна було б довести наявність залишкового метиленовогосинього. Отже, видалення барвника з розчину об'ємом 250 мл вимагає не більше 30-35 хв.
. Фракції об'ємом 10 мл збирають і піддають екстинкції при 660 нм. За даними табл. 15 видно, що весь розчин альбуміну можна пропускати зі швидкістю 5 і 7,5 мл / хв відповідно через колонку без того, щоб в одержуваних фракціях можна було б довести наявність залишкового метиленовогосинього. Отже, видалення барвника з розчину об'ємом 250 мл вимагає не більше 30-35 хв.
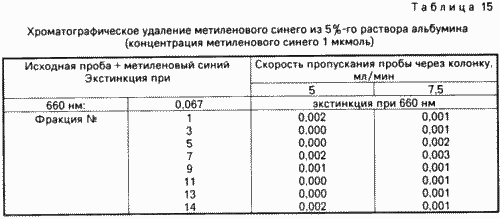
Результати даного досвіду показують, що хроматографическое видалення фотоокіслітеля можна здійснювати без жодних проблем. З іншого боку, доведено вищезгадана можливість отримання містять інактивовані віруси препаратів білків плазми від окремих донорів.
ФОРМУЛА ВИНАХОДУ
СПОСІБ інактивації вірусів В КРОВІ ТА ЇЇ КОМПОНЕНТИ шляхом змішування оброблюваного розчину або суспензії з Фенотіазинові барвником і подальшого опромінення світлом, що відрізняється тим, що фенотіазинового барвник використовують в концентрації 0,1 10 мкмоль, причому опромінення здійснюють безпосередньо в прозорих ємностях, службовців для взяття і зберігання крові.
Спосіб за п.1, що відрізняється тим, що в якості фенотиазинового барвника використовують толуїдиновий синій або метиленовий синій.
Спосіб за п. 1 або 2, який відрізняється тим, що опромінення здійснюють видимим світлом в області максимуму абсорбції відповідного барвника.
Спосіб по одному з пп. -1 3, який відрізняється тим, що опромінення здійснюють при рН середовища 5 9.
Спосіб по одному з пп.1 4, який відрізняється тим, що опромінення здійснюють протягом 5 300 хв.
Спосіб по одному з пп.1 5, що відрізняється тим, що опромінення здійснюють при 0- 37 o С.
Спосіб по одному з пп.1 6, який відрізняється тим, що обробляється розчин або суспензію піддають попередньому заморожування з подальшим розморожуванням перед опроміненням.
Спосіб за п.7, що відрізняється тим, що барвник додають перед процесом заморожування.
Спосіб за п.7, що відрізняється тим, що барвник додають після відтавання.
Спосіб по одному з пп.1 9, який відрізняється тим, що після опромінення кров або її компоненти пропускають через адсорбент для видалення барвника.
Спосіб за п.10, який відрізняється тим, що для його здійснення використовують дві ємності, придатні для взяття крові, з розміщеної між ними адсорбційної колонкою.
Спосіб за п.10 або 11, який відрізняється тим, що в якості адсорбенту використовують агент з групи, що включає силікагель, гель на основі полістиролу і дивинилбензола, полімери складних ефірів акрилової кислоти.
Версія для друку
Дата публікації 08.11.2006гг




Коментарі
Коментуючи, пам'ятайте про те, що зміст і тон Вашого повідомлення можуть зачіпати почуття реальних людей, проявляйте повагу та толерантність до своїх співрозмовників навіть у тому випадку, якщо Ви не поділяєте їхню думку, Ваша поведінка за умов свободи висловлювань та анонімності, наданих інтернетом, змінює не тільки віртуальний, але й реальний світ. Всі коменти приховані з індексу, спам контролюється.