| початок розділу
Виробничі, аматорські радіоаматорські Авіамодельний, ракетомодельного Корисні, цікаві |
хитрощі майстру
електроніка фізика технології винаходи |
таємниці космосу
таємниці Землі таємниці Океану хитрощі Карта розділу |
|
| Використання матеріалів сайту дозволяється за умови посилання (для сайтів - гіперпосилання) | |||
Навігація: => |
На головну / Каталог патентів / В розділ каталогу / Назад / |
|
ВИНАХІД
Патент Російської Федерації RU2205410
![]()
СПОСІБ ОДЕРЖАННЯ антіідіотіпіческіх СИРОВАТКИ ДЛЯ ДІАГНОСТИКИ ЗЛОЯКІСНИХ ПУХЛИН
Ім'я винахідника: Пантелєєв Дмитро Юрійович; Шеїн Юрій Германович
Ім'я патентовласника: Пантелєєв Дмитро Юрійович; Шеїн Юрій Германович
Адреса для листування: 121609, Москва, Осінній б-р, 11, (609 відділення зв'язку), Фірма "ВІС", пат.пов. Н.А. Тріпошіной, рег.№ 472
Дата початку дії патенту: 2000.05.19
Винахід відноситься до галузі медицини, а саме до імунології, і може бути використано для діагностики злоякісних пухлинних захворювань. Суть методу полягає в тому, що в сінгенной системі на першому етапі виробляють введення в організм достовірно сінгенного тваринного клітин ембріональних тканин з хорионом, відповідних 7-12-денним ембріональних тканин мишей, отриманих від вагітних самок тварин цієї ж сінгенной системи, на другому етапі по закінчення 5-14 днів після введення ембріональних клітин від імунізованих тварини забирають лейкоцити і вводять їх в організм сінгенного з попереднім тваринного, а після закінчення 4-12 днів після проведення попередньої імунізації отримують сироватку шляхом забору крові тварини, яку залишають при кімнатній температурі до утворення щільного згустку, а потім центрифугують для повного осідання еритроцитів; отриману сироватку відбирають, прогрівають до 60 o С, сорбують на надлишку гомогената клітин сінгенних тварин з подальшим центрифугуванням і фільтрацією. На обох етапах можлива обробка вводяться клітин антімітотіческім агентами, або введення їх з імуностимуляторами, або заміна цілісних клітин їх мембранної фракцією. Технічним результатом є підвищення ефективності та достовірності діагностики злоякісних пухлинних захворювань.
ОПИС ВИНАХОДИ
Винахід відноситься до галузі медицини, а саме до імунології, і стосується способу отримання антіембріональной антіідіотіпіческіх сироватки, використовуваної в якості одного з агентів при тестуванні пацієнта на предмет діагностики злоякісної пухлини.
За попередній гіпотезі в процесі пухлинного росту і при ембріогенезі існує (функціонує) подібний механізм міжклітинної (межмембранного) взаємодії, на підтвердження цієї гіпотези пропонується використання антіембріональной антіідіотіпіческіх сироватки, дія якої може бути істотно для виявлення пухлинного росту і / або пухлинної прогресії. Аналогічна сироватка використана при створенні способу універсальної діагностики злоякісних пухлин (див. Патент СРСР 1836640, G 01 N 33/80, опубл. 23.08.93).
Відомий спосіб діагностики злоякісної пухлини шляхом дослідження швидкості осідання еритроцитів під дією двох агентів - антіембріональной антіідіотіпіческіх сироватки та контрольної сироватки, при цьому в якості першого агента використовують щурячу сироватку, а другого - сироватку щурів, яким попередньо вводять лімфоцити сінгенних тварин (див. Патент РФ 2111495 , G 01 N 33/80, опубл. 20.05.98). Причому діагностика полягає в знаходженні мінімального і максимального градієнтів швидкості осідання еритроцитів крові пацієнта в даних сироватках і розрахунку за певною формулою коефіцієнта злоякісного росту, величина якого вказує на наявність / відсутність злоякісної пухлини.
В даному способі антіембріональная антіідіотіпіческіх сироватка використовується в якості агента, що змінює швидкість осідання еритроцитів крові пацієнта в порівнянні з контрольною сироваткою в разі наявності злоякісного пухлинного росту клітин.
Винахід направлено на вирішення завдання зі створення антіембріональной антіідіотіпіческіх сироватки, властивості якої дозволяли б візуально контролювати наявність росту клітин злоякісних пухлин незалежно від гістогенезу, що виявляється при люмінесцентної мікроскопії. Досягнутий при цьому технічний результат полягає в підвищенні ефективності та достовірності діагностики злоякісних пухлинних захворювань.
Зазначений технічний результат досягається тим, що при отриманні антіембріональной антіідіотіпіческіх сироватки в сінгенной системі на першому етапі виробляють введення в організм достовірно сінгенного тваринного 7-12-денних клітин ембріональних тканин з хорионом, отриманих від вагітних самок, на другому етапі після закінчення 5-14 днів після введення ембріональних клітин від імунного тваринного забирають лейкоцити і вводять їх в організм іншої, сінгенного з попереднім тваринного, а після закінчення 4-12 днів після проведення останньої імунізації при утворенні достатньої кількості імунного компонента в крові тварини отримують сироватку шляхом забору його крові, яку залишають при кімнатній температурі до утворення щільного згустку, а потім центрифугують для повного осідання еритроцитів; отриману сироватку відбирають, прогрівають до 60 o С, сорбують на надлишку гомогената клітин сінгенних тварин з подальшим центрифугуванням і фільтрацією.
На обох етапах можлива обробка вводяться клітин антімітотіческой агентами, або введення їх з імуностимуляторами, або заміна цілісних клітин їх мембранної фракцією.
Під "достатнім" кількістю імунного компонента в крові тваринного мається на увазі така концентрація імуноглобулінів (класу G і М), яка дозволила б провести описані нижче діагностичні методики. "Достатність" (або концентрацію імунних глобулінів класу G і / або М) можна оцінювати по іншим відомим методикам, наприклад:
a) реакція бласттрансформації лімфоцитів, або
b) реакція преципітації, або
c) імуноферментний аналіз, або
d) радіоімунний аналіз і т.д.
Запропонований спосіб передбачає, що кінцевий продукт, яким є імунна сироватка, забирається від імунного тваринного на кінцевому етапі. Наприклад, в разі 2-етапної імунізації забір крові проводиться від імунного тваринного 2, в разі 3-етапної імунізації від тваринного 3 і т.д.
Імунними компонентами, які отримуються на кінцевому етапі, можуть бути:
a) імунні лімфоцити, які продукують імунні глобуліни класів G і / або М, або
b) моноклональні антитіла, створені на основі зазначених лімфоцитів, або
c) власне імуноглобуліни G і / або М, або
d) Fab фрагменти імуноглобулінів (С), або
e) цільна сироватка як найпростіший варіант.
Зазначені ознаки є суттєвими і взаємопов'язані між собою з утворенням стійкої сукупності істотних ознак, достатньої, щоб отримати сироватку з наступними властивостями:
- В суміші з еритроцитами хворих злоякісними пухлинами відбувається аглютинація еритроцитів в достовірно великому відсотку випадків;
- В методі непрямої імунофлюоресценції виявляється специфічне мембранне (періфіріческой) світіння клітин злоякісних пухлин незалежно від гістогенезу при люмінесцентної мікроскопії, що свідчить про універсальну тропности (сприйнятливості) одержуваної сироватки до пухлинних клітин і може служити підставою для створення патологоанатомічних тест-систем.
Суть методу отримання агента. У строго сінгенной системі проводиться багатоетапна імунізація. У найпростішому випадку її можна обмежити принципово двома етапами. На першому з них виробляється введення в організм достовірно сінгенного тваринного клітин, отриманих від вагітних самок на певному терміні вагітності. Введені клітини містять як клітини власне ембріона, так і клітини хоріона. Після закінчення необхідного періоду часу від імунного тваринного забираються будь-якими способами лейкоцити і вводяться в організм іншої, сінгенного з попереднім тварини. На обох етапах допускається обробка вводяться клітин антімітотіческой агентами, введення їх з імуностимуляторами (адьювантов) або без них або заміна цілісних клітин їх мембранної фракцією. Сироватка (або її імунний компонент) забирається від тварин останньої групи після закінчення часу, необхідного для утворення достатньої кількості імунного компонента в крові тварини після проведення другого етапу імунізації.
Можуть використовуватися будь-які системи сінгенних тварин, переважно використання мишей.
Антіідіотіпіческіх сироватку одержують у такий спосіб.
1. Отримання 12-денних ембріональних клітин мишей лінії BALB (с) і проведення першої імунізації.
На 12 день вагітних самок забивають тракцией шийного відділу хребта або іншим доступним способом. Передню стінку живота обробляють 95% -ним етанолом, розкривають по всій передній поверхні. Два роги матки відокремлюють від підвідних судин (перерізується брижі), матку перерізають у її вагінального відділу і переносять в надлишок холодного розчину версія. Матку розрізають по довжині, браншамі відокремлюють в розчин ембріональні тканини разом з тканинами хоріона. Надлишок розчину версія видаляють пастерівської піпеткою, залишки маток видаляють. Ембріональні тканини з хорионом тонко подрібнюють ножицями і в надлишку свіжого холодного розчину версія переносять на магнітну мішалку в стерильному пеніцилінових флаконі на 25-30 хв. Через зазначений час, суспензія фільтрують через двошаровий марлевий фільтр, клітини тричі відмивають надлишком холодного розчину Хенкса (при 1500 об / хв 3-4 хв). Концентрацію живих клітин в розчині підраховують в камері Горячева за відомою методикою. Попередньо осадивши клітини центрифугуванням при 1500 об / хв, видаляють надлишок розчину Хенкса, а до клітинного осаду вносять НАФ (НАФ - неповний адьювантов Фрейда) з розрахунку 10 млн. Клітин - 0,1 мл НАФ. Суміш ресуспендіруют до утворення стійкої емульсії і вводять покапельно в область спини сінгенним тваринам з розрахунку 0,1 мл емульсії на одного.
2. Проведення другої імунізації.
Через 14 днів після закінчення першого етапу, імунних тварин забивають, проводять попередню обробку і розріз аналогічно зазначеним вище. Видаляють селезінки і переносять їх в гомогенізатор з 4 мл розчину версія. Отриманий гомогенат фільтрують через двошаровий марлевий фільтр, суміш відмивають одноразово в розчині Хенкса і нашаровуються на суміш фіколл-верографін (щільність - 1077). Виділення спленоцитів (тобто лейкоцитів, здобутих з селезінки) в градієнті щільності виробляють при 2000 об / хв протягом 20-25 хв (в залежності від обсягу вихідної суспензії) і продовжують до отримання ясно помітного "кільця", розташованого на кордоні розчинів . Спленоцитах ( "кільце") відбирають тонко відтягнутою Пастерка, одноразово відмивають в розчині Хенкса, суспензія опромінюють. Доза опромінення становить 50 Гр (тобто 5000 рад). Проводять підрахунок клітин і додають до тричі відмитих після опромінення клітин неповний адьювантов Фрейда з того ж розрахунку, що і в п.1. Емульсію вводять внутрішньочеревно сінгенним тваринам з розрахунку 0,1 мл на одного.
3. Отримання сироватки
Через 12 днів після проведення останньої імунізації, проводиться забір крові з порожнин серця під ефірним наркозом. Отриману кров залишають при кімнатній температурі до утворення щільного згустку, центрифугують при 1500 об / хв 2-3 хв для повного осідання еритроцитів. Сироватку відбирають тонко відтягнутою Пастерка, прогрівають при 56 o С 15 хв, сорбують на надлишку гомогената клітин печінки, нирок, селезінки сінгенних мишок BALB (с), центрифугують при 8-9000 об / хв 20 хв, фільтрують мілліпоровие фільтрами (0,22 мкм ).
4. Тестування сироватки. Отриману зазначеним способом сироватку перевіряють в методі непрямої імунофлюоресценції на кріостатних нефіксованих зрізах (6-10 мкм) будь-якого пухлинного штаму (В-16, РШМ-2 та ін.). Сироватка вважається активною, якщо виявляється специфічне мембранне світіння пухлинних клітин в кінцевому розведенні 1: 1.
В окремому випадку реалізації способу можлива обробка вводяться клітин антімітотіческой агентами наступним чином:
a) Ембріональні клітини (в тому числі і з клітинами хоріона) лінійного лабораторного тваринного (наприклад, миша) беруть на певному гестаційному віці, обумовленому терміном вагітності і особливостями розвитку ембріона конкретного виду лабораторних тварин.
b) Клітини, зазначені в п. (а), обробляються відомими антімітотіческой агентами (наприклад, мітоміцін С, гамма-випромінювання або іншими).
c) Параметри і час обробки клітин в п. (b) визначаються достатністю для досягнення зупинки їх мітотичної активності і / або метаболізму.
d) Оброблені по п. (с) клітини вводять в організм сінгенного з цими клітинами лабораторних тварин з відомими імуностимуляторами, що використовуються в імунологічних методиках (наприклад, Повний адьювантов Фрейнда, неповний адьювантов Фрейнда і ін). Спосіб введення визначається параметрами приготованого препарату.
e) Кількість вводиться імуностимулятора визначається кількістю клітин і видом лабораторного тваринного і вважається оптимальним у кожному конкретному випадку, якщо його застосування збільшує концентрацію імунних глобулінів в крові імунного тваринного за більш короткий проміжок часу, ніж без його застосування, або дозволяє отримати велику їх концентрацію за той же період часу, що і без його застосування.
f) Від тварини, обробленого за пп. (d, e), забираються лейкоцити будь-якими відомими способами після певного періоду часу.
g) Період часу по п. (f) вважається достатнім, якщо концентрація імунних глобулінів в крові імунного тварини досягає оптимальних значень. Оптимальною концентрацію імунних глобулінів слід вважати, якщо швидкість її збільшення в крові імунного тваринного починає знижуватися.
h) Лейкоцити, отримані за пп. (f, g), обробляються антімітотіческім агентом аналогічно пп. (b, c).
i) Після проведення обробки лейкоцитів по п. (h) проводять їх введення з імуностимуляторами (як і в пп.d, е) в організм сінгенного з лейкоцитами тварини в кількості і обсязі, оптимальному для отримання оптимального титру антіідіотіпіческіх антитіл.
j) Титр антіідіотіпіческіх антитіл вважається оптимальним, якщо дозволяє виявляти ідіотипи ембріональних стадіоспеціфіческіх антигенів на пухлинних клітинах у відомих тестових методиках.
k) Після досягнення концентрації антіідіотіпіческіх антитіл в крові лабораторних тварин, обробленого за п. (i), достатньої за п. (j), виробляють виділення імунного компонента, склад якого розкритий вище.
Варіантом способу є спосіб, що відрізняється по пп. (D, i), де цільні клітини замінюються їх біологічно активною фракцією (наприклад, їх мембранами або ін). Заміна вважається адекватною, якщо призводить до результату по п. J).
Антіідіотіпіческіх антіембріональная сироватка випробовувалася при реалізації РО-тесту (TURTEST) - біохімічного методу імунологічного розпізнавання антигенів клітин злоякісних новоутворень в крові хворого, заснованого на здатності еритроцитів до аглютинації при взаємодії з даною сироваткою. Виразність цієї реакції кількісно визначають по зміні швидкості осідання еритроцитів при взаємодії з антіідіотіпіческіх антіембріональной сироваткою в порівнянні з їх осіданням в результаті взаємодії з контрольною сироваткою. Коефіцієнт злоякісного росту клітин (К зр) визначають наступним чином: середнє значення, отримане між двома контрольними пробами і робочої пробою з антіідіотіпіческіх антіембріональной сироваткою, ділять на величину 50 і множать на велику величину з 3-х проб. Якщо результат буде перевищувати 1,5, то це свідчить про наявність злоякісного пухлинного процесу в організмі хворого.
Ефективність використання даної сироватки при діагностиці злоякісних пухлин пояснюється наступними прикладами.
приклад 1
Пацієнтка А. з новоутворенням в лівому передсерді була піддана дослідженню на РВ-тест. До зр склав 2,3. Це стало причиною виниклого припущення про наявність злоякісної неоплазми. Після операції гістологія підтвердила злоякісне новоутворення - фіброміксосаркому лівого передсердя.
приклад 2
У хворої С. злоякісна пухлина перикарду (злоякісна мезотеліома) була виявлена після біопсії. Після РО-тесту коефіцієнт злоякісного росту До зр склав 2,8, що підтвердило первинний діагноз злоякісності новоутворення.
приклад 3
У чотирьох хворих з міксома правого передсердя РВ-тест був проведений до операції; До зр склав 0,8. Після операції гістологія підтвердила доброякісний характер новоутворень.
приклад 4
У трьох дітей з рабдоміоми в правих відділах серця РВ-тест був проведений до операції. До зр склав 0,9; 0,96 і 1,1 відповідно. Після проведених операцій гістологія підтвердила наявність неміксоматозних доброякісних пухлин серця - рабдоміом.
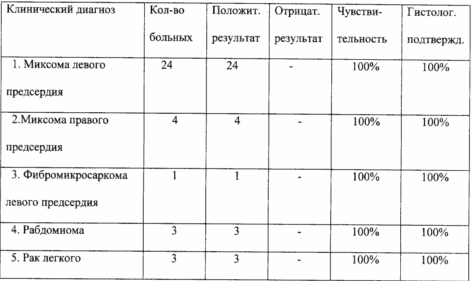
Дослідження проведено на більш ніж 10 000 пацієнтах в різних клініках Російської Федерації. Зокрема, дослідження, проведені в НЦ ССХ ім. А. Н. Бакулєва РАМН і в МСЧ 9 Міністерства охорони здоров'я РФ, показали наступні результати (див. Таблицю). З таблиці видно, що чутливість методу дуже висока і становить майже 100%, підтверджуючи високу діагностичну цінність сироватки, отриманої за способом відповідно до винаходу.
Антіідіотіпіческіх сироватка, що отримується за пропонованим способом, ефективна при діагностиці новоутворень різної локалізації і на будь-якій стадії розвитку пухлинного процесу.
ФОРМУЛА ВИНАХОДУ
1. Спосіб отримання антіідіотіпіческіх сироватки для діагностики злоякісних пухлин, що полягає в тому, що в сінгенной системі на першому етапі виробляють введення в організм достовірно сінгенного тваринного клітин ембріональних тканин з хорионом, відповідних 7-12-денним ембріональних тканин мишей, отриманих від вагітних самок тварин цієї ж сінгенной системи, на другому етапі після закінчення 5-14 днів після введення ембріональних клітин від імунізованих тварини забирають лейкоцити і вводять їх в організм сінгенного з попереднім тваринного, а після закінчення 4-12 днів після проведення попередньої імунізації отримують сироватку шляхом забору крові тваринного , яку залишають при кімнатній температурі до утворення щільного згустку, а потім центрифугують для повного осідання еритроцитів, отриману сироватку відбирають, прогрівають до 60 o с, сорбують на надлишку гомогената клітин сінгенних тварин з подальшим центрифугуванням і фільтрацією.
2. Спосіб за п. 1, який відрізняється тим, що на обох етапах обробляють вводяться клітини антімітотіческой агентами, або вводять їх з імуностимуляторами, або замінюють цільні клітини їх мембранної фракцією.
Версія для друку
Дата публікації 02.04.2007гг




Коментарі
Коментуючи, пам'ятайте про те, що зміст і тон Вашого повідомлення можуть зачіпати почуття реальних людей, проявляйте повагу та толерантність до своїх співрозмовників навіть у тому випадку, якщо Ви не поділяєте їхню думку, Ваша поведінка за умов свободи висловлювань та анонімності, наданих інтернетом, змінює не тільки віртуальний, але й реальний світ. Всі коменти приховані з індексу, спам контролюється.